Eisen(II)-iodid
Eisen(II)-iodid ist eine anorganische chemische Verbindung des Eisens aus der Gruppe der Iodide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Fe2+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eisen(II)-iodid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | FeI2 | ||||||||||||||||||
| Kurzbeschreibung |
rot-violetter Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 309,65 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Eisen(II)-iodid kann durch Reaktion von Eisen mit Iod bei 500 °C gewonnen werden.[4]
Alternativ kann die Synthese durch Umsetzung von frisch reduziertem Eisen mit konzentrierter Iodwasserstoffsäure unter einer Stickstoffatmosphäre in Methanol durchgeführt werden. Das zunächst erhaltene Hexamethanol-Solvat wird dann thermisch zum wasserfreien Iodid zersetzt wird[5]:
Äußerst fein verteiltes Eisen(II)-iodid erhält man durch thermische Zersetzung von Tetracarbonyldiiodidoeisen(II) Fe(CO)4I2.[4]
Eigenschaften
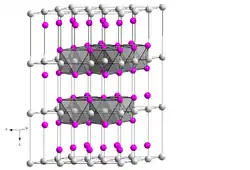
Eisen(II)-iodid ist ein hygroskopischer rotvioletter bis schwarzer Feststoff, der löslich in Wasser, Ethanol und Diethylether ist. In Lösung und an feuchter Luft erfolgt rasche Oxidation.[6] Er wird an der Luft weißlich. Die Lösung in Wasser ist farblos. Er besitzt eine trigonale Kristallstruktur vom Cadmium(II)-hydroxid-Typ mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) (a = 404 pm, c = 675 pm).[4][3] Das Tetrahydrat ist ein schwarzer Feststoff, der löslich in Ethanol und Wasser ist und sich bei 90–98 °C zersetzt.[2]
Verwendung
Eisen(II)-iodid findet Verwendung als Wirkstoff in homöopathischen Arzneimitteln. In dem Anwendungsbereich ist es bekannt als Ferrum jodatum.[7] Die zugeschriebene Wirkung besonders gegen Drüsenerkrankungen ist wissenschaftlich jedoch nicht bestätigt.
Das Tetrahydrat wird als Katalysator und zur Herstellung von Alkaliiodiden verwendet.[2]
Einzelnachweise
- Datenblatt Iron(II) iodide, anhydrous, beads, −10 mesh, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 23. Mai 2020 (PDF).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis, 2011, ISBN 1-4398-1462-7, S. 483 (eingeschränkte Vorschau in der Google-Buchsuche).
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 454 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1645.
- G. Winter: Iron(II) halides. In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973, ISBN 07-071320-0 (defekt), S. 101–104 (englisch).
- Karl-Heinz Lautenschläger: Taschenbuch der Chemie. Harri Deutsch Verlag, 2007, ISBN 978-3-8171-1760-4, S. 410 (eingeschränkte Vorschau in der Google-Buchsuche).
- Markus Wiesenauer: Homöopathie bei chronischen Beschwerden in Große GU Kompasse, S. 91, 106 & 152, Gräfe und Unzer Verlag GmbH, 2012

