Silbersubfluorid
Silbersubfluorid (Ag2F) ist ein bronzefarbener elektrisch leitender Feststoff, in dem Silber formal die Oxidationsstufe +0,5 zukommt.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
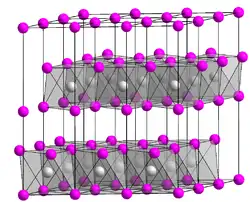 | |||||||
| _ F− _ Ag1/2+ | |||||||
| Allgemeines | |||||||
| Name | Silbersubfluorid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | Ag2F | ||||||
| Kurzbeschreibung |
bronzefarbene bis gelbgrüne Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 234,735 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt |
Zersetzung >100 °C[2] | ||||||
| Löslichkeit |
Zersetzung bei Kontakt mit Wasser[3] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Darstellung und Eigenschaften
Silbersubfluorid kann durch Elektrolyse von AgF an einer Silberkathode bei geringen Stromdichten oder aus fein verteiltem Silber mit AgF in Fluorwasserstoff (HF) hergestellt werden[3]:
Ag2F bildet bronzefarbene trigonale Kristalle, die den elektrischen Strom gut leiten, aber oberhalb von 100 °C in Ag und AgF zerfallen. Die Bildungsenthalpie ∆Hf beträgt −212 kJ. Die Struktur kann als anti-CdI2-Typ (Polytyp 2H) aufgefasst werden, wobei Ag Doppelschichten in einer hexagonal-dichtesten Kugelpackung bildet (Schichtfolge ABAB). In den Oktaederlücken jeder zweiten Schicht befinden sich die F−-Ionen. Die Ag-Ag-Abstände liegen mit 2,996 Å sehr nahe an den Abständen in metallischem Silber (2,89 Å), während die Ag-F-Abstände von 2,814 Å einer ionischen Bindung entsprechen.[2][5]
Siehe auch
Einzelnachweise
- N. N. Greenwood, A. Earnshaw. Chemie der Elemente. 1. korr. Auflage. VCH, Weinheim, 1990, S. 1516, ISBN 3-527-26169-9.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1343–1344.
- Lee Poyer et al.: Disilver fluoride (Silver "subfluoride"). In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 18–21 (englisch).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 239–240.