Titan(II)-chlorid
Titan(II)-chlorid ist eine chemische Verbindung des Titans aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Ti2+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Titan(II)-chlorid | |||||||||||||||
| Andere Namen |
Titandichlorid | |||||||||||||||
| Verhältnisformel | TiCl2 | |||||||||||||||
| Kurzbeschreibung |
schwarzer, selbstentzündlicher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 118,79 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,13 g·cm−3 [1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1500 °C[2] | |||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Gewöhnlich wird Titan(II)-chlorid durch thermale Disproportionierung von Titan(III)-chlorid bei 500 °C gewonnen, wobei durch die bereits einsetzende Zersetzungsreaktion von Titan(II)-chlorid zu Titan(IV)-chlorid und Titan mit dieser Methode kein reines Produkt erhalten werden kann und dieses stets 2 – 3 % freies Titan enthält.[3]
Titan(II)-chlorid kann auch durch Reaktion von Titan mit Titan(IV)-chlorid gewonnen werden.[3]
In sehr reiner und fein verteilter Form kann Titan(II)-chlorid durch Reduktion von Titan(IV)-chlorid mit Wasserstoff in einer elektrodenlosen elektrischen Entladung gewonnen werden.[3]
Eigenschaften
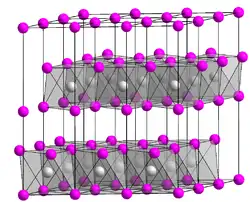
Titan(II)-chlorid ist ein starkes Reduktionsmittel (reagiert heftig mit Wasser und Sauerstoff) und besitzt eine geschichtete Cadmiumdiiodid-Kristallstruktur, wobei das Titan(II) oktaedrisch zu sechs Chloridliganden positioniert ist.[4][5] Es bildet mit Derivate bzw. Komplexverbindungen in der TiCl2(R)2 wobei R ein Chelat (z. B. dppe oder TMEDA) oder ein Salz (z. B. Natriumchlorid) sein kann. Es hat eine trigonale Kristallstruktur vom Cadmium(II)-iodid-Typ (Polytyp 2H) mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) und den Gitterparametern a = 356,1, c = 587,5 pm.[3]
Verwendung
Titan(II)-chlorid kann zur Herstellung von reinem Titan und als Mediator bei organischen Synthesen verwendet werden.
Sicherheitshinweise
Titan(II)-chlorid ist selbstentzündlich (hängt u. a. von der Korngröße ab) und bildet bei Kontakt mit Wasser oder feuchter Luft hochentzündliche Gase. Die Reaktion mit Wasser verläuft heftig.
Einzelnachweise
- Eintrag zu Titan(II)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Datenblatt bei WebElements (englisch)
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1334.
- E. L. Gal'perin, R. A. Sandler: TiCl2. In: Kristallografiya. 1962, 7, S. 217–219.
- N.C. Baenziger,R. E. Rundle: The structure of TiCl2. In: Acta Crystallographica. 1948, 1, S. 274-, doi:10.1107/S0365110X48000740.

