Magnesiumiodid
Magnesiumiodid (MgI2) ist eine chemische Verbindung, das Magnesiumsalz der Iodwasserstoffsäure. Sie tritt, außer als wasserfreies Anhydrat, auch in mehreren Hydratformen MgI2·(H2O)x, so als Hexa- und Octahydrat, auf.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
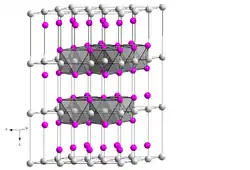 | |||||||||||||||||||
| _ Mg2+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Magnesiumiodid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | MgI2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 278,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,43 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser (1480 g·l−1 bei 18 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Magnesiumiodid kann direkt aus den Elementen Magnesium und Iod unter Erhitzen und Ausschluss von Luft bzw. Sauerstoff gewonnen werden[3]:
Möglich ist auch die Herstellung durch Reaktion von Magnesium mit Quecksilber(II)-iodid.[3]
Eigenschaften
Magnesiumiodid ist eine farblose, geruchlose, sehr gut wasserlösliche, trigonal-kristalline Festsubstanz, die wegen ihrer Hygroskopie und Empfindlichkeit gegenüber Luft unter trockenem Schutzgas (meist Argon) aufbewahrt werden muss.[1] Mit Wasser bildet es verschiedene Hydrate (MgI2 · 6 H2O, MgI2 · 8 H2O, MgI2 · 9 H2O). An der Luft zersetzt es sich allmählich unter Braunfärbung zu elementarem Iod, Magnesiumhydroxid und Wasser.
Magnesiumiodid gehört wie viele andere Halogenide und Hydroxide zweiwertiger Metalle oder Sulfide und Telluride vierwertiger Metalle zum Polytyp 2H der CdI2-Struktur (a = 4,14 Å, c = 6,88 Å). Es ist äußerst hygroskopisch. Aus seiner wässrigen Lösung kristallisiert bei gewöhnlicher Temperatur das Oktahydrat, oberhalb 43 °C ist das Hexahydrat beständig.[3]
Einzelnachweise
- Datenblatt Magnesiumiodid bei AlfaAesar, abgerufen am 26. Dezember 2019 (PDF) (JavaScript erforderlich).
- Datenblatt auf Webelements.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 906.