Nickel(II)-hydroxid
Nickel(II)-hydroxid ist eine chemische Verbindung des Metalls Nickel, die zur Gruppe der Hydroxide gehört.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
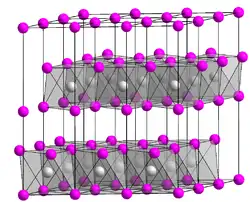 | |||||||||||||||||||
| _ Ni2+ _ OH− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nickel(II)-hydroxid | ||||||||||||||||||
| Andere Namen |
Nickeldihydroxid | ||||||||||||||||||
| Verhältnisformel | Ni(OH)2 | ||||||||||||||||||
| Kurzbeschreibung |
apfelgrünes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 92,71 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,1 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Natürlich kommt Nickel(II)-hydroxid in Form des sehr seltenen Minerals Theophrastit vor.[4]
Gewinnung und Darstellung
-hydroxid.jpg.webp)
Nickel(II)-hydroxid entsteht beim Nachweis von Nickel-Ionen aus Nickelsalzlösungen mit Natronlauge als Ausfällung mit deutlicher Grünfärbung:
- Nickel(II)-Ionen aus Nickelsalzlösungen (wie z. B. in Wasser aufgelöstes Nickel(II)-chlorid) reagieren mit Natronlauge zu grünem, wasserunlöslichem Nickel(II)-hydroxid und Natrium-Ionen.
Bei Überschuss von Ammoniak löst sich das Nickel(II)-hydroxid unter Blaufärbung als Hexaammin-Komplex wieder auf:
- Nickel(II)-Ionen reagieren bei Überschuss von Ammoniak zu blauen, wasserlöslichen Hexaamminnickel(II)-Ionen und Hydroxid-Ionen.
Chemische Eigenschaften
Durch Zugabe von starken Oxidationsmitteln wie Chlor oder Brom, jedoch nicht mit Wasserstoffperoxid, geht Nickel(II)-hydroxid in das schwarze Nickel(IV)-oxid über:
- Grünes Nickel(II)-hydroxid reagiert mit Brom zu schwarzem, wasserunlöslichem Nickel(IV)-oxid und Bromwasserstoff.
Durch elektrolytische Oxidation entsteht aus Nickel(II)-hydroxid Nickel(III)-oxid bzw. Nickel(III)-oxidhydroxid. Dieser reversible Vorgang ist für den Nickel-Cadmium-Akkumulator und Nickel-Eisen-Akkumulator von Bedeutung.
Es existiert mit 3Ni(OH)2 2H2O auch ein grünes und im trockenen Zustand stabiles Hydrat.[5]
Verwendung
Nickel(II)-hydroxid wird zum Galvanisieren, als Hauptbestandteil für Platten alkalischer Akkumulatoren (siehe Nickel-Eisen-Akku, Nickel-Cadmium-Akkumulator, Nickel-Wasserstoff-Akkumulator und Nickel-Metallhydrid-Akkumulator) und zum Herstellen von Nickelkatalysatoren verwendet[6].
Sicherheitshinweise
Wie viele Nickelverbindungen wird Nickel(II)-hydroxid als krebserzeugend (Kategorie 1A), reproduktionstoxisch (Kategorie 1B) und keimzellmutagen (Kategorie 2) eingestuft.[1] Zusätzlich wirkt Nickel(II)-hydroxid sensibilisierend.[1]
Einzelnachweise
- Eintrag zu Nickel(II)-hydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Nickel dihydroxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Nickel(II) hydroxide (PDF) bei Fisher Scientific, abgerufen am 13. Februar 2014.
- Mineralienatlas.de: Theophrastit
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1691.
- Schweizerische Eidgenossenschaft: Erzeugnisse der chemischen Industrie oder verwandter Industrien (Memento des Originals vom 6. Februar 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.


