Cadmiumfluorid
Cadmiumfluorid ist eine chemische Verbindung aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
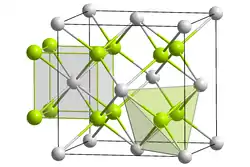 | ||||||||||||||||
| _ Cd2+ _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cadmiumfluorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | CdF2 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 150,41 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
6,64 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1748 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend (CMR), ernsthafte Auswirkungen auf die menschliche Gesundheit gelten als wahrscheinlich[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Cadmiumfluorid kann durch Reaktion von Cadmiumcarbonat mit Flusssäure gewonnen werden.
Eigenschaften
Cadmiumfluorid besitzt eine kubische Kristallstruktur des Fluorit-Typs.[4] Dünnschichten von Cadmiumfluorid zeigen Photolumineszenz.[7] Bei Temperaturen über 1000 °C beginnt sich die Verbindung zu zersetzen.[1]
Verwendung
Cadmiumfluorid wird als Isolator in der Hochfrequenzhalbleitertechnik verwendet und kommt auch in Fluorit-Gläsern vor.
Sicherheitshinweise
Cadmiumfluorid ist hochgiftig und wie viele Cadmiumverbindungen als krebserzeugend und keimzellmutagen eingestuft. Hauptaufnahmewege sind der Atem- und Verdauungstrakt, möglich ist auch die Resorption über die Haut.[1]
Literatur
- T. Dote, K. Adachi, E. Yamadori, M. Imanishi, H. Tsuji, E. Tanida, K. Kono: Abnormalities in cadmium fluoride kinetics in serum, bile, and urine after single intravenous administration of toxic doses to rats. In: Journal of occupational health. Band 50, Nummer 4, 2008, S. 339–347, PMID 18525160. PDF
- Paul F. Weller: Electrical and Optical Properties of Rare Earth Doped Cadmium Fluoride Single Crystals. In: Inorganic Chemistry. 4, 1965, S. 1545, doi:10.1021/ic50033a004.
- B. A. Orlowski, P. Plenkiewicz: Electronic Band Structure of CdF2. Photoemission Experiment and Pseudopotential Calculations. In: physica status solidi. 126, 1984, S. 285, doi:10.1002/pssb.2221260134.
Einzelnachweise
- Eintrag zu Cadmiumfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- H. Kojima, S. G. Whiteway, C. R. Masson: Melting points of inorganic fluorides. In: Canadian Journal of Chemistry. 46 (18), 1968, S. 2968–2971, doi:10.1139/v68-494.
- CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6.
- Eintrag zu Cadmium fluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. März 2015.
- Patent US4194141A: Electroluminescent unit. Angemeldet am 28. September 1978, veröffentlicht am 18. März 1980, Anmelder: OS Bad Rozwojowy Monokrysztalo, Warszawaki Uniwersytet Instytu, Erfinder: Barbara Krukowska-Fulde et Al.


