Tetraboran
Tetraboran, genauer Tetraboran-10, ist eine anorganische chemische Verbindung aus der Gruppe der Borane.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
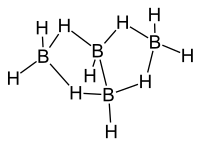 | |||||||
| Allgemeines | |||||||
| Name | Tetraboran | ||||||
| Andere Namen |
| ||||||
| Summenformel | B4H10 | ||||||
| Kurzbeschreibung |
unangenehm riechendes Gas[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 53,32 g·mol−1 | ||||||
| Aggregatzustand |
gasförmig[2] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
17,6 °C[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Tetraboran entsteht durch Zersetzung von Diboran bei Temperaturen oberhalb von 50 °C, wobei auch Wasserstoff und höhere Boranen (Pentaboran, Hexaboran, Decaboran und andere) entstehen. Eine Ausbeute von bis zu 95 % Ausbeute wird bei einem Druck von 170 kPa zwischen zwei konzentrische Glasrohren erreicht, von denen das innere auf 120 °C geheizt und das äußere auf −78 °C gekühlt wird („Heiß-Kalt-Reaktor“). Es entsteht auch bei der Hydrolyse von Magnesiumdiborid.[1]
Es lässt sich auch durch Reaktion von Ioddiboran mit Natrium gewinnen.[2]
Eigenschaften
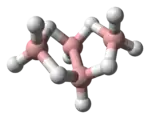
Tetraboran ist ein unangenehm riechendes Gas. Reines Tetraboran entzündet sich nicht an Luft, wird jedoch durch Wasser zu Borsäure und Wasserstoff hydrolysiert. Es zersetzt sich bei Raumtemperatur in einigen Stunden (bei höheren Temperaturen rascher) zu anderen Boranen.[1] Bis 100 °C zerfällt es hauptsächlich in Wasserstoff, Diboran und Pentaboran-9, bei höherer Temperatur in Wasserstoff, Pentaboran-9, Hexaboran und borreiche Hydride.[2] Es wird von Brom und Chlor weit langsamer angegriffen als Diboran.[4]
Einzelnachweise
- Eintrag zu Tetraboran(10). In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. September 2017.
- Karl A. Hofmann: Anorganische Chemie. Springer-Verlag, 2013, ISBN 978-3-663-14240-9, S. 400 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Karl A. Hofmann: Lehrbuch der anorganischen Experimentalchemie. Springer-Verlag, 2013, ISBN 978-3-663-04369-0, S. 383 (eingeschränkte Vorschau in der Google-Buchsuche).