Amminboran
Amminboran ist eine chemische Verbindung aus der Gruppe der Borane.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
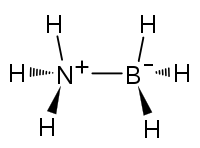 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Amminboran | |||||||||||||||
| Andere Namen |
Borazan | |||||||||||||||
| Summenformel | BH6N | |||||||||||||||
| Kurzbeschreibung |
weißes bis beiges kristallines Pulver mit ammoniakartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 30,87 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Die Reaktion von Diboran mit flüssigem Ammoniak bei −78 °C ergibt hauptsächlich dessen Diammoniumsalz [H2B(NH3)2]+(BH4)−. Wenn jedoch anstelle von Diboran der THF-Komplex von Boran eingesetzt wird, ergibt sich Amminboran.[3]
Eigenschaften
Amminboran hat eine Struktur ähnlich der von Ethan, wobei die große Differenz des Schmelzpunktes der beiden Verbindungen durch die stark polare Natur von Amminboran zustande kommt. Die B-N Entfernung beträgt 1,58 Å, die B-H Entfernung 1,15 Å und die N-H Entfernung 0,96 Å.
Verwendung
Amminboran wird als Speichersubstanz für Wasserstoffgas als Treibstoff für Fahrzeuge diskutiert.[4] Der Wasserstoff kann durch Erhitzung freigesetzt werden, wobei sich Amminboran zuerst zu (NH2BH2)n und dann zu (NHBH)n zersetzt.[5] Die Wasserstoffspeicherdichte von Amminboran ist höher als die von flüssigem Wasserstoff.[6]
Amminboran wird auch bei organischen Synthesen als stabile Variante von Diboran eingesetzt.[7]
Einzelnachweise
- Ammonia borane (GfsChemicals) (Memento vom 17. Januar 2016 im Internet Archive) (PDF; 43 kB, englisch)
- Datenblatt Borane-ammonia complex bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- S.G. Shore, K.W. Boeddeker: Large Scale Synthesis of H2B(NH3)2+BH4− and H3NBH3. In: Inorganic Chemistry. 1964, 3, S. 914–15, doi:10.1021/ic50016a038.
- Wiedergeburt für Wasserstofftanks (Technology Review).
- "Hydrogen gets on board", Maciej Gutowski and Tom Autrey, Royal Society of Chemistry.
- Frances H. Stephens, Vincent Pons, R. Tom Baker: Ammonia borane: the hydrogen source par excellence?. In: Dalton Transactions, 2007, S. 2613–2626, doi:10.1039/b703053c.
- G.C. Andrews: Borane Ammonia. In Encyclopedia of Reagents for Organic Synthesis, 2004, doi:10.1002/047084289X.rb238.pub2.