Bernhard Kadenbach
Bernhard Kadenbach (* 21. August 1933 in Luckenwalde; † 14. April 2021 in Marburg) war ein deutscher Biochemiker mit Forschungsschwerpunkt Struktur und Funktion der mitochondrialen Cytochrom-c-Oxidase, der als Professor am Fachbereich Chemie der Philipps-Universität Marburg tätig war.

Leben
Akademische Laufbahn
Bernhard Kadenbach wurde als fünftes von acht Kindern des Gewerbeoberlehrers Bernhard Kadenbach und seiner Ehefrau Elfriede (geb. Brix) in Luckenwalde geboren. Nach dem Abitur 1952 an der Gerhart-Hauptmann-Schule in Luckenwalde studierte Kadenbach ab 1952 Chemie an der Humboldt-Universität zu Berlin – zu dieser Zeit war Robert Havemann Dekan der naturwissenschaftlichen Fakultät und Direktor des Instituts für Physikalische Chemie. Kadenbach schloss das Studium 1959 mit dem Diplom ab. Die Diplomarbeit unter Betreuung des Organikers Otto Neunhoeffer erfolgte in der Robert-Rössle-Krebs-Klinik der Akademie der Wissenschaften der DDR (DAdW) in Berlin-Buch, damals eine der renommiertesten biomedizinischen Forschungskliniken der Ostblockländer.[1]
Von 1959 bis 1961 arbeitete Kadenbach an gleicher Stelle als Forschungsassistent. Während dieser Zeit absolvierte er im Jahr 1960 einen einjährigen Forschungsaufenthalt im Labor von Lars Ernster und Olaf Lindberg am Wenner-Gren-Institut der Universität Stockholm. Kadenbach kehrte im Dezember 1960 nach Ost-Berlin zurück. Da Otto Neunhoeffer Berlin bereits 1960 verlassen hatte, um in den Westen an die Universität des Saarlandes, Saarbrücken, zu gehen, begann Kadenbach seine Doktorarbeit unter Samuel Mitja Rapoport. Ende August 1961 schließlich verließ Kadenbach die DDR mit falschen Papieren.
Ab 1961 folgte eine Assistenzzeit bei Theodor Bücher am Institut für Physiologische Chemie der Philipps-Universität Marburg, die Kadenbach 1964 mit der Promotion abschloss, worauf ein DFG-Forschungsstipendium bis 1968 an gleicher Stelle folgte. Von 1969 bis 1971 war er Wissenschaftlicher Assistent am Lehrstuhl für physikalische Biochemie der Ludwig-Maximilians-Universität München bei Martin Klingenberg, der auch bei Theodor Bücher in Marburg über Mitochondrien gearbeitet hatte, und dessen Interesse dem ADP-ATP-Transporter galt.

Kadenbach wurde 1970 an der Universität Konstanz habilitiert und arbeitete von 1971 bis 1973 als Oberassistent und Dozent im Laboratorium für Biochemie der Eidgenössischen Technischen Hochschule Zürich bei Carl Martius.
Im Oktober 1973 wurde Kadenbach auf eine Professur für Biochemie am Fachbereich Chemie der Philipps-Universität Marburg berufen, die er bis zu seiner Pensionierung 1998 innehatte.
Von 2001 bis 2011 betreute Kadenbach als aktiver Wissenschaftler in DFG-geförderten Projekten weiterhin zwei Doktoranden im Biomedizinischen Forschungszentrum (BMFZ) am Klinikum der Philipps-Universität Marburg und gewährleistete die Betreuung von technischen Mitarbeitern im Labor der Herzchirurgie.
Kadenbach war ab 1964 verheiratet. Aus der Ehe gingen zwei Kinder hervor.[2]
Forschungsgebiete
Von 1973 bis 2010 wurden unter der Leitung von Kadenbach 76 Diplomarbeiten im Fach Chemie/Biochemie angefertigt, und 45 Doktoranden schlossen mit einer Promotion ab (Dissertationen nach Forschungsgebieten): 31 thematisch zur Cytochrom-c-Oxidase, sieben zu mitochondrialen Myopathien, vier zum mitochondrialen Phosphat-Transport und drei zu biochemischer und biomedizinischer Methodik und Analytik.
Mitochondrialer Phosphat-Transport

Von 1973 bis 1982, als weder das Gen noch die Aminosäuresequenz des mitochondrialen Phosphat-Transport-Proteins bekannt waren, untersuchten Kadenbach und Mitarbeiter Phosphat-Bindung von mitochondrialen Extrakten und Phosphat-Aufnahme in isolierten Mitochondrien.[3] In letzterem Fall wurde die kompetitive Hemmung des Transports mit reversiblen Sulfhydryl-Reagenzien (organische Quecksilberverbindung wie Mersalyl und Salze der Ethylmercurithiosalicylsäure)[4] und dem irreversiblen SH-Inhibitor N-Ethylmaleinimid untersucht, um einerseits die Spezifität des Phosphat-Transporters gegenüber dem Dicarboxylat-Transporter, einem anderen Mitglied der Familie mitochondrialer Carrier, abzugrenzen und andererseits die Substratspezifität dieses Transmembranproteins zu bestimmen.[5]
Zur Aufreinigung des Phosphat-Transporters wurden Fraktionen mitochondrialer Membranen durch nicht-ionische Detergentien solubilisiert und partiell über Hydroxylapatit und andere stationäre Phasen aufgereinigt, bis eine proteinanalytische Identifizierung des Phosphat-Transporters durch SDS-PAGE möglich war (Mr um 32 kDa).[6] Rekonstitution des aufgereinigten Phosphat-Transporters in Liposomen zeigte spezifisch hemmbaren Phosphat-Transport,[7] der in Gegenwart des in Mitochondrien natürlich vorkommenden Cardiolipins eine stimulierte Aktivität zeigte.[8]
Expression
Am Beispiel von Cytochrom c[9] untersuchte Kadenbach bereits gegen Ende der 1960er Jahre die cytoplasmatische Biosynthese mitochondrialer Proteine.[10] Er zeigte, dass einige Untereinheiten der Cytochrom-c-Oxidase (COX) cytosolisch, und andere mitochondrial (d. h. im Innern der Mitochondrien) synthetisiert werden.[11]
Untereinheiten und cDNAs
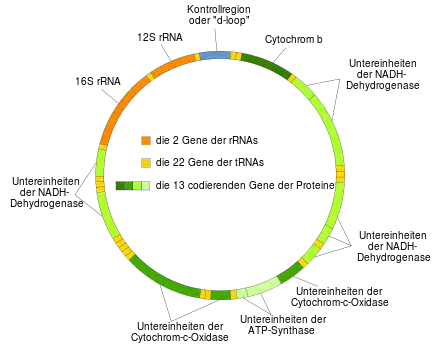
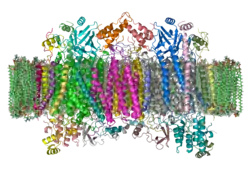
1983 wiesen Kadenbach und Mitarbeiter proteinanalytisch nach, dass aus Mitochondrien verschiedener Säugetiere aufgereinigte COX-Proteinkomplexe jeweils aus 13 individuellen Untereinheiten bestehen.[12] Diese große Anzahl an unterscheidbaren Untereinheiten wurde lange Zeit unter Mitochondriologen nicht anerkannt und heftig diskutiert.[13] Erst 13 Jahre später erfolgte der endgültige Beweis durch die Aufklärung der Kristallstruktur des COX-Multimers durch Yoshikawa und Mitarbeiter,[14] wodurch die Lage der 13 Proteine zueinander sichtbar wurde.
Obwohl COX-Komplexe bei Bakterien und Säugetieren die gleiche enzymatische Funktion haben, enthalten bakterielle COX-Komplexe nur 3 Untereinheiten.[15] Für einige der 10 zusätzlichen Untereinheiten im Säugetier wurden regulatorische Funktionen nachgewiesen. Gegen jede einzelne der 13 Untereinheiten der COX wurden in Marburg polyklonale und monoklonale Antikörper hergestellt.[16] Erstmals wurden gewebsspezifische Isoformen der COX-Untereinheiten VIa, VIIa, und VIII beschrieben,[17] und Unterschiede in der kinetischen Aktivität der aus verschiedenen Organen isolierten COX gezeigt.[18] Die variable Expression von Isoenzymen der COX wurde auch in verschiedenen Muskelfasern des Menschen immunhistochemisch nachgewiesen.[19]
Die Gene (cDNAs) für die beiden (Herz- und Leber-)Isoformen der Untereinheit VIa[20] sowie für weitere Untereinheiten[21] wurden isoliert und sequenziert und die chromosomalen Genstrukturen für die Untereinheiten VIc und VIa wurden bestimmt.[22] In menschlichem Gewebe konnte auch die entwicklungsspezifische (fötal/adult) Expression der Isoformen gezeigt werden.[23][24]
Kinetik und Regulation
Bindungsstudien von Kadenbach und Mitarbeitern zeigten an isolierter COX aus Rinderherz 10 hochaffine ADP-Bindungsstellen.[25][26] Diese 10 ADP-Bindungsstellen wurden in der Kristallstruktur durch Einlagerung von 10 Cholatmolekülen (ähnliche Raumstruktur[27]) bestätigt.[26] Messungen der Stöchiometrie des Protonentransports der isolierten, in Liposomen rekonstituierten COX bestätigten eine funktionelle Regulation durch das ADP/ATP-Verhältnis.[28][29]
Ein weiterer allosterischer Mechanismus der Atmungskontrolle durch das ATP/ADP-Verhältnis wurde durch Bindung speziell an die Untereinheit IV gefunden.[30][31][32][33] Arbeiten zwischen 2000 und 2011 führten Kadenbach schließlich zur Formulierung einer Hypothese bezüglich der Rolle der COX-Regulation in Hinsicht auf den Alterungsprozess und zur Entstehung degenerativer Krankheiten bei Mensch und Tier.[34]
Mitochondriale Myopathien
Die in Kadenbachs Arbeitsgruppe hergestellten Antikörper gegen die COX-Untereinheiten[35] wurden zum immunhistochemischen Nachweis von mitochondrialen Myopathien mit COX-Defekt eingesetzt. In Zusammenarbeit mit Josef Müller-Höcker[36] gelang es erstmals, die Zunahme von COX-defekten Zellen im Muskel[37] und in der Leber von gesunden Menschen mit zunehmendem Alter nachzuweisen.
Mit der Methode des „mispairing PCR“ wurden Punktmutationen in Proben von Patienten mit MERRF-Syndrom identifiziert[38] und als häufige Ursache für verschiedene neuromuskuläre Erkrankungen nachgewiesen. Zusätzlich wurde mit zwei unterschiedlichen Nachweismethoden[39] gefunden, dass die für MERRF charakteristischen Punktmutationen mit zunehmendem Alter selbst in gesunden Probanden zunehmen.[40]
Es wurde postuliert, dass die Lebenszeit des Menschen auch dadurch begrenzt ist, dass durch statistische Mutationen der mitochondrialen DNA (mtDNA), die mit zunehmendem Alter akkumulieren, COX-defiziente Zellen entstehen.[41]
Philosophische Aspekte der Naturwissenschaften
2016 publizierte Kadenbach das Buch Wozu lebt der Mensch und woher kommt das Böse? Gedanken und Ansichten eines Naturwissenschaftlers.[42]
Mitgliedschaften
- Mitglied der Gesellschaft für Biochemie und Molekularbiologie seit 1963
- Mitglied der New York Academy of Sciences seit 1990
Publikationen
- 1959 (Diplom) Der Einfluß von Chlorpromazin auf die oxidative Phosphorylierung von Tumormitochondrien
- 1964 (Dissertation) Der Einfluß von Thyreoidhormonen in vivo auf die oxydative Phosphorylierung und Enzymaktivitäten in Mitochondrien
- 1970 (Habilitation) Die Biosynthese von Cytochrom-c
Von 1959 bis 2012 publizierte Kadenbach 237 Artikel in nationalen und internationalen Journalen. Die folgenden Publikationen sind dabei besonders hervorzuheben:
- P. Merle und B. Kadenbach: The subunit composition of mammalian cytochrome c oxidase, Eur J Biochem 105, 499–507 (1980).
- B. Kadenbach, P. Mende, H.V.J. Kolbe, I. Stipani und F. Palmieri: The mitochondrial phosphate carrier has an essential requirement for cardiolipin, FEBS Lett. 139, 109–112 (1982).
- B. Kadenbach, C. Münscher, V. Frank, J. Müller-Höcker und J. Napiwotzki: Human aging is associated with stochastic somatic mutations of mitochondrial DNA, Mutation Res. 338, 161–172 (1995).
- B. Kadenbach (Hrsg.): Mitochondrial Oxidative Phosphorylation. Nuclear-Encodes Genes, Enzyme Regulation, and Pathophysiology (Advances in Medical Medicine and Biology 748), Springer-Verlag (2012) ISBN 9781461435723.
- B. Kadenbach: Der Mensch, ein elektrisches Wesen, Chemie in unserer Zeit 49, 2–7 (2015).
- B. Kadenbach und M. Hüttemann: The subunit composition and function of mammalian cytochrome c oxidase, Mitochondrion 24, 64–76 (2015).
Literatur
- Kürschners Deutscher Gelehrten-Kalender online, Ref.-Nr. P34933
- Christian Reichardt und Dorothea Schulz: Kurze Übersicht über die Entwicklung des Fachs Chemie an der Philipps-Universität Marburg von 1609 bis zur Gegenwart (PDF; 4,4 MB), 4. verbesserte und ergänzte Auflage, Marburg (2012)
Weblinks
- Literatur von und über Bernhard Kadenbach in der bibliografischen Datenbank WorldCat
Einzelnachweise
- Ernst Peter Fischer: Die Charité: Ein Krankenhaus in Berlin – 1710 bis heute, Siedler Verlag (2010), S. 2 f.
- Bernhard Kadenbach. In: novumverlag.com. Abgerufen am 15. April 2021.
- P. Hadvary und B. Kadenbach: Identification of a membrane protein involved in mitochondrial phosphate transport, Eur. J. Biochem. 65, 573–581 (1976).
- H. Freitag und B. Kadenbach Inhibition of malate transport and activation of phosphate transport in mitochondria by ethylmercurithiosalicylate, FEBS Lett. 117, 149–151 (1980).
- H. Freitag und B. Kadenbach: Transport of phosphate analogues in rat liver mitochondria, Eur. J. Biochem. 83, 53–57 (1978).
- H.V.J. Kolbe, P. Mende und B. Kadenbach: The protein component(s) of the isolated phosphate-transport system of mitochondria, Eur. J. Biochem. 128, 97–105 (1982).
- P. Mende, H.V.J. Kolbe, B. Kadenbach, I. Stipani, und F. Palmieri: Reconstitution of the isolated phosphate transport system of pig-heart mitochondria, Eur. J. Biochem. 128, 91–95 (1982).
- P. Mende, F.-J. Hüther und B. Kadenbach: Specific and reversible activation and inactivation of the mitochondrial phosphate carrier by cardiolipin and nonionic detergents, respectively, FEBS Lett. 158, 331–334 (1983).
- B. Kadenbach: Biosynthesis of cytochrome c. The sites of synthesis of apoprotein and holoenzyme, Eur. J. Biochem. 12, 392–398 (1970).
- B. Kadenbach: Synthesis of mitochondrial proteins. Demonstration of a transfer of proteins from microsomes into mitochondria, Biochim. Biophys. Acta 134, 430–443 (1967).
- Vortrag bei dem Meeting "Autonomy and Biogenesis of Mitochondria and Chloroplasts" vom 8. bis 13. Dezember 1969 in Canberra, Australien und publiziert unter B. Kadenbach: Biosynthesis of mitochondrial cytochromes, in: "Autonomy and biogenesis of mitochondria and chloroplasts" (N.K. Boardman, A.W. Linnane and R.M. Smillie, eds.), North-Holland, Amsterdam, London, S. 360–371 (1971).
- B. Kadenbach, J. Jarausch, R. Hartmann und P. Merle: Separation of mammalian cytochrome c oxidase into 13 poly-peptides by a sodium dodecyl sulfate-gel electrophoretic procedure, Anal. Biochem. 129, 517–521 (1983).
- B. Kadenbach, M. Ungibauer, J. Jarausch, U. Büge und L. Kuhn-Nentwig: The complexity of respiratory complexes, Trends Biochem. Sci. 8, 398–400 (1983).
- T. Tsukihara, H. Aoyama, E. Yamashita, T. Tomizaki, H. Yamaguchi, K. Shinzawa-Itoh, R. Nakashima, R. Yaono und S. Yoshikawa: The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A, Science. 272, 1136–1144 (1996).
- Die den Bakterien analogen Untereinheiten I bis III werden von mitochondrialer DNA codiert und im Organell synthetisiert (siehe auch Endosymbiontentheorie). Die Biosynthese der zusätzlichen 10 Untereinheiten im Säugetier erfolgt im Zytosol.
- Auf Nachfrage wurden die monoklonalen Antikörper gegen die einzelnen COX-Untereinheiten aus Rinderherz-Mitochondrien als spezifische Nachweisreagenzien weltweit verschickt.
- B. Kadenbach, R. Hartmann, R. Glanville und G. Buse: Tissue-specific genes code for polypeptide VIa of beef liver and heart cytochrome c oxidase, FEBS Lett. 138, 236–238 (1982).
- P. Merle und B. Kadenbach: Kinetic and structural differences between cytochrome c oxidases from beef liver and heart, Eur. J. Biochem. 125, 239–244 (1982).
- N. Romero, C. Marsac, M. Fardeau, M. Droste, B. Schneyder und B. Kadenbach: Immunohistochemical demonstration of fibre type-specific isozymes of cytochrome c oxidase in human skeletal muscle Histochemistry 94, 211–215 (1990).
- A. Schlerf, M. Droste, M. Winter und B. Kadenbach: Characterization of two different genes (cDNA) for cytochrome c oxidase subunit VIa from heart and liver of the rat, EMBO J. 7, 2387–2391 (1988).
- Untereinheiten VIc und VIII aus Hepatomzellen (Ratte), Va (Herz, Ratte), IV (fötale Leber, Ratte), VIa (Leber Mensch), VIIa (Leber, Ratte), und VIII (Herz, Ratte)
- O. Mell, P. Seibel und B. Kadenbach: Structural organization of the rat genes encoding liver- and heart-type of cytochrome c oxidase subunit VIa and a pseudogene related to the COXVIa-L cDNA, Gene 140, 179–186 (1994).
- Analysen wurden mit Northern Blots (cDNA-Nachweis) sowie durch Western Blots (immunologischer Protein-Nachweis) durchgeführt.
- G. Bonne, P. Seibel, S. Possekel, C. Marsac und B. Kadenbach: Expression of human cytochrome c oxidase subunits during fetal development, Eur. J. Biochem. 217, 1099–1107 (1993).
- Die Besetzung dieser Bindungstellen mit ADP hängt vom ATP/ADP-Verhältnis ab. Bei hohem ATP/ADP-Verhältnis wird ADP gegen ATP ausgetauscht.
- J. Napiwotzki, K. Shinzawa-Itoh, S. Yoshikawa und B. Kadenbach: ATP and ADP bind to cytochrome c oxidase and regulate its activity, Biol. Chem., 378, 1013–1021 (1997).
- B. Ludwig, E. Bender, S. Arnold, M. Hüttemann, I. Lee und B. Kadenbach Cytochrome c oxidase and the regulation of oxidative phosphorylation (Memento vom 26. Juni 2015 im Internet Archive), ChemBioChem 2, 392–403 (2001).
- Beim Rinderherz-Enzym (Herz-Typ) wurde bei hohem ATP/ADP-Verhältnis (Bindung an Untereinheit VIa) eine Reduktion der H+/e−-Stöchiometrie von 1.0 auf 0.5 gefunden
- V. Frank und B. Kadenbach: Regulation of the H+/e--stoichiometry of cytochrome c oxidase from bovine heart by intraliposomal ATP/ADP ratios, FEBS Lett., 382, 121–124 (1996).
- Dieser Mechanismus beruht auf der allosterischen Hemmung der COX bei hohem ATP/ADP-Verhältnis: d. h. die polarographische Messung des Sauerstoffverbrauchs mit zunehmender Cytochrom-c-Konzentration zeigt eine sigmoidale Hemmkurve. Dieser Mechanismus wird aufgehoben (a) bei niedrigem ATP/ADP-Verhältnis, (b) durch Bindung von 3,5-Dijodthyronin (T2) an die Untereinheit Va, (c) durch Expression der Isoform IV-2 (M. Hüttemann, B. Kadenbach und L.I. Grossman: Mammalian subunit IV isoforms of cytochrome c oxidase, Gene 267, 111–123 (2001)) und (d) durch Dephosphorylierung der COX (I. Lee, E. Bender, S. Arnold und B. Kadenbach: Minireview-Hypothesis. New control of mitochondrial membrane potential and ROS-formation, Biol. Chem. 382, 1629–1633 (2001)).
- S. Arnold und B. Kadenbach: Priority Paper. Cell respiration is controlled by ATP, an allosteric inhibitor of cytochrome c oxidase, Eur. J. Biochem. 249, 350–354 (1997).
- B. Kadenbach und S. Arnold: Minireview. A second mechanism of respiratory control, FEBS Lett. 447, 131–134 (1999).
- B. Kadenbach, R. Ramzan, L. Wen und Vogt: New extension of the Mitchell Theory for oxidative phosphorylation in mitochondria of living organisms, Biochim. Biophys. Acta 1800, 205–212 (2010).
- B. Kadenbach, R. Ramzan und S. Vogt: High efficiency versus maximal performance — The cause of oxidative stress in eukaryotes: A hypothesis, Mitochondrion 13 (2013) S. 1–6
- L. Kuhn-Nentwig und B. Kadenbach: Isolation and properties of cytochrome c oxidase from rat liver and quantification of immunological differences between isozymes from various rat tissues with subunit-specific antisera Eur. J. Biochem. 149, 147–158 (1985).
- Pathologe an der Ludwig-Maximilians-Universität München mit Fachgebieten: COX-Defizienz in Biopsien von Kearns-Sayre-Syndrom-Patienten; gewebs- und untereinheitenspezifische Defekte der COX in Autopsiematerial von Säuglingen
- J. Müller-Höcker, K. Schneiderbanger, F.H. Stefani und B. Kadenbach: Progressive loss of cytochrome-c-oxidase in the human extraocular muscles in ageing – a cytochemical-immunohistochemical study, Mutation Research 275, 115–124 (1992).
- P. Seibel, F. Degoul, N. Romero, C. Marsac und B. Kadenbach: Identification of point mutations by mispairing PCR as exemplified in MERRF disease, Biochem. Biophys. Res. Commun. 173, 561–565 (1990).
- C. Münscher, T. Rieger, J. Müller-Höcker und B. Kadenbach: The point mutation of mitochondrial DNA characteristic for MERRF disease is found also in healthy people of different age, FEBS Lett., 317, 27–30 (1993).
- Keine Mutationen in der mtDNA bei unter 20-Jährigen, 2 % in einem 74-jährigen, 2.4 % in einem 89-jährigen Probanden.
- B. Kadenbach und J. Müller-Höcker: Mutations of mitochondrial DNA and human death, Naturwissenschaften 77, 221–225 (1990).
- B. Kadenbach: Wozu lebt der Mensch und woher kommt das Böse? Gedanken und Ansichten eines Naturwissenschaftlers, Novum-Verlag (2016), ISBN 978-3-95840-054-2.