Augenevolution
Die Augenevolution befasst sich mit den evolutionären Schritten zur stammesgeschichtlichen Entstehung des Auges und ihrer Erforschung.
Die Komplexität des Wirbeltierauges gab in der Vergangenheit wiederholt Anlass zu Kritik an der Evolutionstheorie. Die Unklarheiten in dieser Frage können heute als historisch und überwunden gelten. Die Evolutionsschritte von einfachen Augenflecken und Lochaugen bis zum hochentwickelten Wirbeltierauge sind heute als Progressionsreihe darstellbar. Voraussetzung für die Evolution von Augen waren lichtempfindliche Pigmentzellen in frühen ein- oder mehrzelligen Augenflecken. Darauf aufbauend evolvierten seit dem Beginn des Kambriums echte Augen. Evolutionäre Unterschiede existieren bis heute nicht nur zwischen verschiedenen Augentypen, sondern auch beim Wirbeltierauge selbst. In der Evolution existieren bei rezenten Tieren für alle stammesgeschichtlichen Komplexitätsgrade von Augentypen ökologische Nischen.
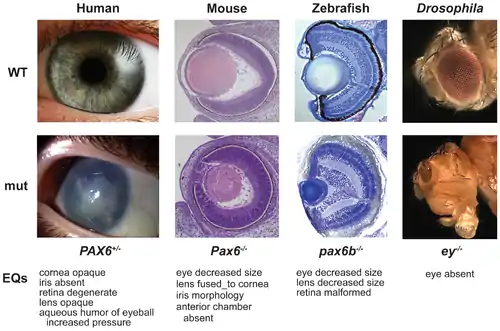
Für die frühe Initiierung des Auges wurde das Pax6-Gen als notwendig und hinreichend in der gesamten Tierwelt gesehen. Diese Auffassung weicht einer Sicht, dass Genregulationsnetzwerke das Auge initiieren. Kontrovers diskutiert wird die Frage, ob das Auge einmal (homolog) oder mehrmals (konvergent) in der Evolution entstanden ist. Die Genkomponenten sind sehr alt und einmalig, die Funktionseinheiten des Auges, wie etwa die Linse, mehrfach unabhängig entstanden.
Das Auge im Tierreich
95 % der Tierarten besitzen Augen. Unter den 38 Bauplänen im Tierreich sind es sechs. Unter den Tieren mit Augen sind der Stamm der Chordatiere bzw. deren Unterstamm die Wirbeltiere mit ca. 40.000 Arten, die Mollusken mit Muscheln, Schnecken und Tintenfischen ca. 100.000 Arten und die Arthropoden mit Krebstieren, Spinnen und Insekten mit mehr als einer Million Arten. Die Stämme mit Augen dominieren somit das Tierreich.[1]
Diese Dominanz wird darauf zurückgeführt, dass bereits im Verlauf der kambrischen Explosion vor 540 Millionen Jahren bei Trilobiten entwickelte Augen existierten und das Auge die Evolution der Tierstämme in der kambrischen Explosion steuerte, einer Periode evolutionär sehr schneller Ausbildung der Diversität im Tierreich. Dabei entstanden nach Andrew Parker durch Sehen und Gesehenwerden ausgeprägte Anpassungen in Form von Räuber-Beute-Strukturen.[2] Sehen und Gesehenwerden hatten grundlegenden Einfluss auf die sexuelle Selektion im Tierreich.
Die Größenentwicklung der Tiere in dieser Phase wird als notwendige Voraussetzung für die Evolution echter Augen gesehen. Eine große Linse, eine großflächige Netzhaut und ein Gehirn zur Signalverarbeitung sind nur größeren Tieren möglich, wie sie das frühe Kambrium in vielen Bauplanvarianten hervorbrachte.[1]
Bedeutende Forscher und ihre Entdeckungen
Darwins Vision
Schon Darwin stellte sich der Frage, wie das Auge evolutionär entstanden sein konnte, wenn es aus so vielen „unnachahmlichen Vorrichtungen“ besteht, die scheinbar erst in ihrer rezenten Form und Funktion ein funktionierendes System ergeben können. Obgleich an dieser Sichtweise lange festgehalten wurde, hat sie sich als falsch erwiesen. Ein einfach gebautes Flachauge oder das aus ihm entstandene Grubenauge kann ebenfalls funktionieren. So besitzen etwa Seeigel aneinander gereihte Fotorezeptoren an ihren Beinen.[3] Trotz der von Darwin selbst eingeräumten Schwierigkeiten, die Evolution eines so komplexen Organs mit seiner Theorie zu erklären, war er sicher, dass künftige Generationen Antworten auf die Frage finden würden, wie das Auge „von einem unvollkommenen und einfachen zu einem vollkommenen und zusammengesetzten Auge […] durch natürliche Zuchtwahl gebildet werden könne“[4].
Grundlagenforschung zu Licht, Nerven und Fotorezeptoren

Die Schwierigkeiten, das aus seinen sich ergänzenden Einzelteilen bestehende Auge evolutionär erklären zu können, hielten nach Darwins Tod noch mehr als 100 Jahre an. Zunächst mussten in der Physik Kenntnisse über die Eigenschaften des Lichts und sein Farbspektrum sowie seine Zusammensetzung, gewonnen werden: Thomas Young zur Wellennatur des Lichts, Hermann von Helmholtz zur Dreifarbentheorie und andere (siehe: Farbwahrnehmung).
Zu den Biologen, die grundlegende Arbeiten über die Physiologie des Auges und damit grundlegende Voraussetzungen zur Evolution des Auges beitrugen, gehörte der Spanier Santiago Ramón y Cajal. Er entdeckte bei seinen Studien zur Feinstruktur des Nervensystems die Struktur der Netzhaut und dort im Besonderen, wie die Nervenzellen durch Bipolare Zellen der Retina verbunden sind.[5] 1942 erschien das umfassende Werk des Amerikaners Gordon Lynn Walls (1905–1962), The vertebrate eye and its adaptive radiation[6] unter anderem mit detaillierten, auch zeichnerischen Einblicken in die Struktur unterschiedlicher Fotorezeptoren und der Netzhaut. Walls entdeckte eine Vielfalt von Stäbchen und Zapfen in Vertebratenaugen, ermittelte daraus die gemeinsamen Eigenschaften verschiedener Arten von Fotorezeptoren und erkannte als erster, dass das Stäbchen eine spezialisierte Zelle ist, die sich aus einem Urzapfen entwickelt haben muss.[7] Daneben befasst er sich mit der Bewegung der Augen.
Dem Amerikaner George Wald gelang neben vielen anderen Entdeckungen die Entschlüsselung der Funktion von Vitamin A in der Retina und des Sehpurpurs oder Rhodopsins in den Stäbchen der Retina. Wald zeigte in berühmt gewordenen Farbdiagrammen die Lichtabsorption der Stäbchen (schwarz) sowie später auch die Absorption der Zapfen (rot, grün, blau).[8] Er lieferte in der Folge revolutionäre Arbeiten zu der Idee, Stammbäume der Tiere anhand der Geschichte von Molekülen zu erstellen (Kap. 4). 1975 entdeckte er, dass Amphibien und Meeresfische eine gemeinsame Rhodopsinform verwenden.[9] Damit kam er der Bestätigung einer bereits 1882 von Theodor Engelmann gemachten Hypothese nahe, dass Rhodopsin, das in den Augen aller Tiere vorkommt, in einem sehr frühen Evolutionsstadium entstanden sein müsse, noch vor den Augen.
Wichtige Entdeckungen zum Farbsehen kamen von dem amerikanischen Molekularbiologen und Genetiker Jeremy Nathans (* 1958), dem es als erstem gelang, Opsin zu isolieren und zu charakterisieren und damit weiter zum Wissen über das Farbsehen beizutragen.[10][11] Nathans erkannte, dass sich die Gene für rot-grün-Opsine — sie liegen beide auf dem X-Chromosom und haben einen anderen Entwicklungspfad als das Gen für das blau-Opsin — sehr wenig unterscheiden und besonders anfällig für Mutationen sind. Das ließ Rückschlüsse auf deren Evolution zu.
Jüngere Forschung zu EvoDevo und der Modellierung einer Progressionsreihe
Alle Entdeckungen bis dahin waren Grundlagenerkenntnisse für die Evolution des Auges. Ein Durchbruch erfolgte erst in den 1990er Jahren mit den Arbeiten des Schweizer Entwicklungsbiologen Walter Gehring. Gehrings Team entdeckte 1995 das Mastergen Pax6, das in allen Tieren eine Initialfunktion für die embryonale Augenentwicklung darstellt (Kap. 8). Damit wurde die Sicht auf die Evolution des Auges grundlegend neu ausgerichtet, da Gehring nach seiner Entdeckung die Hypothese vertritt, das Auge sei in der Tierwelt nur einmal, also homolog entstanden.[12]
Davor wurde als erstem von dem Evolutionsbiologen Ernst Mayr konsequent die These vertreten, das Auge sei mindestens 40 mal unabhängig, also konvergent entstanden (Kap. 9).[13] In jedem Fall gab die Entdeckung Gehrings der in den 1990er Jahren entstehenden Disziplin der Evolutionären Entwicklungsbiologie (EvoDevo) von der genetischen Seite starken Auftrieb. Genregulationsnetzwerke zur Induktion des Auges wurden entdeckt (Kap. 8).[14] Jüngere, weltweit anerkannte Arbeiten stammen von dem schwedischen Zoologen Dan-Erik Nilsson (* 1954) und dem britischen Neurobiologen Michael F. Land (* 1943). Von Nilsson und Land erschien 1992 Animal Eyes, ein Standardwerk der biologischen Sehforschung.[15] 1994 publizierten Nilsson und Pelger ein Modell für die schrittweise Evolution des Linsenauges (Kap. 5.2).
Damit war erstmals seit Darwins Hypothese ein gangbarer Weg aufgezeigt, dass das Auge in evolutionärer Zeit tatsächlich entstehen konnte. Nilsson publizierte seitdem mehr als 20 wichtige Arbeiten über die Augenevolution von Wirbeltieren und Wirbellosen.[16] Zuletzt erschien 2013 von ihm eine Studie, die den engmaschigen Zusammenhang der Entwicklung des Sehens und der Vielzahl entsprechender, durch Sehen bedingter Verhaltensweisen aufzeigt.[17] Homologe Linien der Fotorezeptoren[18] und Fotorezeptorzelltypen[3] wurden vorgeschlagen (Kap. 4).
2007 erschien von dem australischen visuellen Neurowissenschaftler Trevor Lamb und Mitarbeitern eine Studie, die die vorkambrische Evolution von Opsinen und Fotorezeptoren aufzeigte und die Evolutionsschritte der wichtigen Komponenten des Wirbeltierauges seit Beginn des Kambriums in chronostratigrafischen Zeiteinheiten zusammenhängend darstellte (Kap. 5.1).[19]
Die Probleme, das Auge evolutionär zu erklären, können mit der heutigen Kenntnis seiner Entwicklung mit genetischen und gewebemäßigen Auslöseprozessen (Induktionsketten) als überwunden gelten. Das Wirbeltierauge ist als ein klassisches Beispiel einer Progressionsreihe aus einfacher gebauten Zwischenstadien hervorgegangen (Kap. 5.2).
Methoden zur Erforschung der Augenevolution
Da die Anatomie des Auges fossil nicht im Detail überliefert ist und zudem der Fossilbericht der frühesten Wirbeltiere und ihrer unmittelbaren Vorfahren faktisch unbekannt ist, basieren die im Folgenden getroffenen Aussagen über die Evolution des Auges auf
- vergleichend-anatomischen Studien des Aufbaus des Auges (auch auf molekularer Ebene) in den einzelnen rezenten Wirbeltiergroßgruppen
- molekulargenetischen Untersuchungen der Verwandtschaftsverhältnisse dieser Wirbeltiergruppen
- dem Einsatz der Molekularen Uhr, der es ermöglicht, die Evolutionsschritte einem in der Vergangenheit liegenden Zeitraum zuzuordnen
- vergleichenden Studien zur Embryonalentwicklung in den einzelnen rezenten Wirbeltiergroßgruppen
Evolution des Sehpigments Rhodopsin und der Fotorezeptorzelltypen bei Einzellern
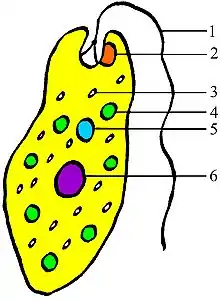
Die Voraussetzung zur Entwicklung echter Augen bilden abgewandelte Nervenzellen in Form lichtempfindlicher Sinneszellen, sogenannte Fotorezeptoren, mit dem Sehpigment Rhodopsin, auch Sehfarbstoff genannt. Dieses Pigment besteht aus einer jeweils bestimmten Variante des Proteins Opsin und aus Retinal, einer Vitamin A Variante.
Ein Sehpigment kann immer nur einen bestimmten Ausschnitt aus dem Lichtspektrum absorbieren, z. B. violettes, kurzwelliges Licht oder rotes, langwelliges Licht. Die Opsine sind sich in ihrer Struktur weitgehend ähnlich und gehen auf einen gemeinsamen Opsinvorfahren zurück. Ihre Unterschiede, die evolutionär durch Duplikation und Divergenz entstanden, ermöglichen, dass Evolutionsstammbäume der Opsine abgebildet werden.[20]
Eine Darstellung, dass Rhodopsin in der Evolution nur einmal entstand, lieferte dann eine Studie 2004.[18] Danach besitzt Platynereis dumerilii (ein rezenter Ringelwurm), beide der bekannten Typen von Rhodopsin, sowohl dasjenige in den Augen der Wirbeltiere, das zum Sehen verwendet wird, als auch dasjenige im Gehirn von Nicht-Wirbeltieren, das in Zellen vorkommt, die nicht zum Sehen verwendet werden. Vorfahren des augenlosen Ringelwurms zählen zu den gemeinsamen Vorfahren der Wirbeltiere und der Wirbellosen und haben die beiden Rhodopsintypen aus einem gemeinsamen evolviert. Es kann daher als wahrscheinlich angenommen werden, dass beide Rhodopsintypen in dieser Wurmlinie ihren gemeinsamen Vorfahren haben.
Noch 1996 schloss Dan-Erik Nilsson nicht aus, Photorezeptorzellen könnten mehrfach evolviert worden sein.[21] Einen Hinweis darauf, dass neben der auf eine Linie zurückgehenden Evolution von Rhodopsin auch die beiden Sehpigmentzelltypen (Abb. 5) aus einem gemeinsamen Vorgänger entstanden, ergab jüngst die Entdeckung von Augen beim Seeigel. Seeigel wurden bis zur Entdeckung von äußerlich nicht sichtbaren, clusterartig gebündelten Fotorezeptoren in den Füßen der Tiere als augenlos angenommen. Seeigel sind Neumünder. Bisher unterschied man Urmünder (Protostomia) mit generell mikrovillären Fotorezeptoren, das sind solche mit der Einlagerung des Sehpigments in Ausstülpungen der nach außen gerichteten Fotorezeptorzelle und Neumünder (Deuterostomia) mit generell ziliären Fotorezeptoren mit Wimpernhärchen. Die Fotorezeptoren des Seeigels sind vom mikrovillären Typ. Da die Seeigel zu den Neumündern gehören, hatte man hier den ziliären Fotorezeptortyp erwartet. Da aber, wie jetzt ersichtlich, beide Fotorezeptortypen bei den Neumündern vorkommen, muss nun entgegen früherer Sichtweise für alle Typen ein gemeinsamer Vorgänger angenommen werden.[3]
Bei der Absorption von Licht wandelt der Fotorezeptor, bzw. Retinal die Lichtenergie mittels einer räumlichen Umformung seiner Proteinstruktur (Konformationsänderung) in spezifische Nervenimpulse um, die als elektrische Signale über Nervenbahnen weitergeleitet werden. Fotorezeptoren existierten in der Stammesgeschichte lange bevor die Evolution von Augen im Kambrium einsetzte. Das früheste Vorkommen von Rhodopsin, und damit die frühesten Augenflecken, waren vermutlich in Vorfahren der heutigen Algen. So besitzt die Grünalge (Volvox) einen Augenfleck mit dem Pigment Rhodopsin.
Von den Algen existiert keine stammesgeschichtliche (phylogenetische) Verbindung zu den Tieren, so dass der gemeinsame Vorfahre mit Rhodopsin bei den Cyanobakterien, der Vorgängerlinie von Chloroplasten gesucht werden muss. Diese sind auch die Vorfahren der Einzeller und damit der Tiere.
Einzeller (Abb. 4) wie Dinoflagellaten besitzen bereits in einer einzigen Zelle das kleinste bekannte Miniauge und verwenden Rhodopsin.[22] Ebenso hat die einzellige Grünalge Chlamydomonas bereits eine komplexe optische Struktur mit vielfältigen Pigmentschichten, die als Reflektoren wirken, die Licht sammeln und bündeln. Sogar eine kugelförmige, transparente Linse existiert bei dem Einzellern Erythropsis.[7]
Augenflecken sind häufig unter einzelligen Organismen, darunter auch beim Augentierchen und später in nahezu allen größeren Tiergruppen. Wegen der großen Verbreitung ist es wahrscheinlich, dass die Mehrzahl von Tieren mit Augenflecken und Fotorezeptoren noch nicht entdeckt ist.[17] Der Augenfleck erlaubt dem Lebewesen Hell und Dunkel zu unterscheiden. Dies ist für die Erkennung der Tageslänge und die Synchronisierung mit dem Tagesrhythmus (Photoperiodismus) ausreichend. Zusammen mit einer Geißel (Flagellum) kann es sich gezielt zum Licht hinbewegen (Lokomotion).
Evolution des Wirbeltierauges
Evolutionsschritte
Die Evolution des Wirbeltierauges lässt sich nach Trevor Lamb grob in sechs Phasen gliedern (Abb. 1).[23] Danach hatten in einer ersten Phase bereits vor 600 Millionen Jahren einfache bilaterale Tiere rhabdomerartige (bürstenförmige) und ziliare (mit Wimpern ausgestattete) Fotorezeptoren mit entsprechenden frühen Formen des Sehpigment-Proteins Opsin entwickelt (Abb. 5). In diese Sehpigmente sind lichtempfindliche Farbstoffe (Chromophoren) integriert, die entscheidend für die Licht-Wahrnehmung bei Tieren (Phototaxis) sind. Die Rezeptoren können dabei in sogenannten Augenflecken (Ocelli) konzentriert gewesen sein oder sie waren über den ganzen Körper verteilt.

In einer zweiten Phase zwischen 580 und 550 Millionen Jahren (spätes Proterozoikum) hatten die unmittelbaren Vorfahren der ersten Wirbeltiere fortgeschrittene ziliare Fotorezeptoren mit entsprechendem Opsin-Protein entwickelt. Diese waren den Fotorezeptoren der heute lebenden engsten Verwandten der Wirbeltiere, des Lanzettfischchens (Branchiostoma) und denen der lanzettfischchenähnlichen Larven der Manteltierchen (Tunicata), vermutlich sehr ähnlich.
In Phase drei, vor etwa 550–530 Millionen Jahren (frühes Kambrium), gab es bereits einen Fotorezeptortyp mit Außenmembran und einem für eine abgestufte Signalübertragung an der Synapse geeigneten Ausgang. Das Gewebe des Nervenknotens in der Kopfregion („Gehirn“) bildete beidseitig mit Fotorezeptoren bestückte Ausstülpungen (Vesikel, Augenbläschen). Diese Augenbläschen begannen sich nachfolgend wiederum becherförmig einzustülpen, wobei die Innenseite des Bechers die früheste Form der Netzhaut (Retina) darstellt. Mit der Einstülpung des Vesikels ging zudem die Anlagerung einer Frühform des Netzhautpigmentepithels an die „Proto-Netzhaut“ einher. Zudem entstand die Linsenplakode, homolog der gleichnamigen embryonalen Linsenanlage höherer Wirbeltiere. Die Linsenplakode verhinderte aber zunächst nur die Pigmentierung der über dem Augenvesikel liegenden Außenhaut des Kopfes, sodass die Außenhaut an diesen Stellen lichtdurchlässig blieb. Dieses frühe Auge, vor etwa 530 Millionen Jahren, noch ohne die bilderzeugenden Fähigkeiten der Netzhaut, kann mit dem der rezenten Schleimaale (Myxinoidea), den ursprünglichsten rezenten Wirbeltieren, verglichen werden.
Im nächsten, vierten Abschnitt vor etwa 530–500 Millionen Jahren (mittleres Kambrium) evolvierten fünf verschiedene neuartige Fotorezeptorzellen, die Zapfen, jede mit ihrem eigenen ziliaren Opsin, sowie Bipolarzellen und neuartige retinale Ganglionzellen (sogenannte biplexiforme retinale Ganglionzellen) als Voraussetzung für die anspruchsvollere Signalweiterleitung zum Sehnerv. Bipolarzellen und Ganglionzellen sind hierbei in einer drei-lagigen Nervenstruktur innerhalb der Netzhaut organisiert. Durch Einstülpung der Linsenplakode in den Augenbecher und anschließende Abschnürung entsteht die Linse. Akkommodation und Iris (und damit die Möglichkeit einer beschränkten Größenveränderung der Pupille) kamen später hinzu, sowie, für die Augenbewegung, extra-okulare Muskeln mit Nervenanbindung. In diesem Zeitraum, vor etwa 500 Millionen Jahren, existierte somit bereits ein Auge, das dem fast aller heutigen Wirbeltiere in Grundzügen vergleichbar war. Es hatte die Bauweise einer einfachen Kamera, konnte daher Bilder sehen und war dem Auge des heutigen Neunauges (Petromyzon) am ähnlichsten.
In Phase fünf, vor 500–430 Millionen Jahren (spätes Kambrium bis spätes Silur), evolvierte Myelin, das für eine schnellere Signalweiterleitung im gesamten Nervensystem sorgt. Dazu kommt ein weiterer neuer Fotorezeptor-Typ, die Stäbchen, die das Sehen bei schwachem Licht ermöglichen. Die Stäbchen nutzten das für Wirbeltiere charakteristische Sehpigment Rhodopsin. Die Iris wurde hoch kontraktil und konnte die Pupillengröße nunmehr optimal an die Lichtverhältnisse anpassen (Adaptation). An der Innenseite des Augapfels entstanden Muskeln für die Linse, die eine verbesserte Akkommodation ermöglichten. Dieses schon relativ hoch entwickelte Auge kennzeichnete vermutlich die heute ausgestorbenen gepanzerten kieferlosen Fische („Ostracodermi“) und wahrscheinlich war es auch jenem Auge sehr ähnlich, das bei vielen heutigen Fischen, und damit bei kiefertragenden Wirbeltieren (Gnathostomen), anzutreffen ist.
Vor weniger als 430 Millionen Jahren wurde in der letzten, sechsten Phase die Linsenoberfläche transparent, die Linse nahm später, im Zuge der Entwicklung der Landwirbeltiere (Tetrapoden) ab ca. 375 Millionen Jahren (spätes Devon), eine im Querschnitt elliptische Form an. Dies war nötig, da das Licht beim Übergang von Luft in die Hornhaut stärker gebrochen wird, als beim Übergang von Wasser in die Hornhaut. Zum Schutz der Augen vor Austrocknung an der Luft entstand das Augenlid. Das Auge entwickelte nach und nach eine immer bessere Sehschärfe und Akkommodationsfähigkeit.[23]
Zusammenfassend lässt sich sagen, dass das Wirbeltierauge von den einfachsten, nur hell-dunkel unterscheidenden Vorgängerformen bis zum modernen, zum Sehen hoch aufgelöster, farbiger Bilder befähigten Linsenauge der meisten Gnathostomen einen Evolutionszeitraum von etwa 200 Millionen Jahren benötigte. Alle grundlegenden Merkmale, die auch das Auges des Menschen auszeichnen, könnten nach weiteren 50 Millionen Jahren, am Ende des Devons, bereits vorhanden gewesen sein. Mehr als 200 Millionen Jahre später reduzierte eine Reihe endothermer und damit zur nachtaktiven Lebensweise fähiger Landwirbeltiere (z. B. Eulen oder Katzen) einige dafür unnötige Fotorezeptoren wieder. Sie passten ihre Netzhaut noch anderweitig an das Nachtsehen an. Daneben treten auch in anderen Entwicklungslinien der Kiefermäuler Spezialisierungen des Auges mit entsprechender Modifikation des Gnathostomen-Grundtypus auf.
Linsenevolution

Die Linse ist eine evolutionäre Innovation als ein diskretes neues Element, das dem Bauplan hinzugefügt wird. Jedoch traten die Bestandteile der Linse nicht erst mit ihrem Erscheinen im Organismus auf. Die wichtigsten Proteine, aus denen die Wirbeltierlinse besteht, die drei Kristalline vom Typ alpha, beta und gamma, mussten nicht evolutionär speziell für das Auge entwickelt werden, was die Erklärung einer schrittweisen Evolution des Auges plausibler macht. Linsenproteine sind opportunistische Proteine; sie stammen von existierenden Proteinen mit anderen Funktionen in anderen Teilen des Organismus ab[24], so etwa in Gehirn, Leber, Lunge, Herz. Im Verlauf der Evolution spezialisierten sie sich in der Linse und nahmen neue Aufgaben an (Exaptation). Entscheidender als ihre molekulare Veränderung ist jedoch die bei den Wirbeltieren entstandene neuartige Anordnung der Kristalline in der Linse[25] in Form zwiebelartiger Verschalung, die begleitet ist vom Abbau des Zellkerns und der Organellen der Linsenfaserzellen, wodurch erst eine lebenslange Überdauerung des Linsenkerns gewährleistet wird (Augenentwicklung (Wirbeltiere)).
Weshalb manche Kristalline Enzymcharakter haben, ist heute nicht geklärt.[1] Die Schwierigkeit, das Entstehen der Linse als von der Netzhaut unabhängige Augenkomponente evolutionär erklären zu können, kann als überwunden gelten, seit das Vorhandensein von Kristallinen in Organismen ohne Augen sowie der Induktionsmechanismus für die Induktion der Linsenplakode bekannt sind, die die schrittweise embryonale Entwicklung des Wirbeltierauges steuern. War eine erste, primitive, plane Linse vorhanden, war ihre evolutionäre Weiterentwicklung ein wiederholter Prozess von Variation und natürlicher Selektion, in dessen Verlauf sich eine verbesserte ovale, transparente und eigenelastische und damit akkommodationsfähige Linse nach und nach entwickeln konnte (Abb. 7).
Ein Modell für die Evolution eines Linsenauges von Nilsson und Pelger (1994) berechnete 1829 notwendige Einzelschritte und dafür 364.000 erforderliche Generationen bzw. Jahre beim Fisch. Das Modell beginnt mit einem linsenlosen Flachauge und enthält in der Endausbaustufe ein Wirbeltier-Linsenauge ohne additive Zusätze wie Iris oder Muskeln (Abb. 7). Es wurde von einer phänotypischen Veränderungsrate von 1 % je Generation ausgegangen. Diese Veränderungsrate entspricht so kleinen Schritten, dass sie durch genetischen Wandel vorstellbar ist.
Weitere realistische Annahmen über Selektion, Erblichkeit und Variationskoeffizient, dem Maß wie viel Variation in einer Population vorhanden ist, wurden gemacht. So wurde etwa bei der Intensität der Selektion zugrunde gelegt, dass auf 101 Tiere, die mit einer Verbesserung überlebten, 100 Tiere kamen, die auch ohne sie überlebten.
Das Modell nennt sich pessimistisch, da die Annahmen so getroffen wurden, dass die simulierte Evolution des Auges eher zu langsam als zu schnell abläuft. Bis dahin ging man immer wieder von der Annahme aus, dass die Evolution eines so komplizierten, aus vielen Teilen bestehenden Organs wie das Auge unglaublich lange dauern muss. Tatsächlich konnte nach den Ergebnissen des Modells das Linsenauge in weniger als einer halben Million Jahre und damit in einem erdgeschichtlich sehr kurzen Zeitraum evolvieren.[26]
Richard Dawkins kommentiert das: „Er [der Zeitraum] ist so kurz, dass er in den Fossilgeschichten der alten Zeit, um die es hier geht, als ein einziger Augenblick erscheinen würde. Der Einwand, für die Evolution des Auges sei nicht genug Zeit gewesen, ist also nicht nur einfach falsch, sondern er ist zutiefst, entschieden und schmählich falsch.“[27]
Die Linse kann neben der Netzhaut als einer der beiden großen Komplexe des Wirbeltierauges gesehen werden. Während die Linse zusammen mit Hornhaut und Iris das einfallende Licht bündelt und auf die dahinterliegende Netzhaut fokussiert, sorgt die Netzhaut für die Umwandlung der Lichtsignale in elektrische Signale und für deren Weiterleitung zum Gehirn, wo die Endverarbeitung der Informationen erfolgt.
Heute ist anerkannt, dass selbst eine primitive Linse, die noch keine Unterstützung durch eine Hornhaut besitzt und nicht akkommodieren kann, evolutionär eine bessere Sehfähigkeit besitzt als ein Auge ohne Linse. Es verfügt bereits über eine gewisse Bildauflösungsfähigkeit. Augen ohne Linse, wie sie die Garnele Rimicaris exoculata auf ihrem Rücken besitzt (Abb. 6), ein Tier, das in der Nähe von Schloten in tiefen Meeresgewässern lebt, ist dagegen evolutionär vorteilhafter als gar kein Auge.[25][1] Die Lichtempfindlichkeit ist hier maximal, die Bildauflösungsfähigkeit minimal.
Lichtabgewandte und lichtzugewandte Lage der Fotorezeptoren
Das Wirbeltier- und das Kopffüßerauge sind ähnliche Konstruktionen. Beide sind Kameraaugen mit einer Linse vorn und einer Netzhaut hinten. Dennoch sind sie konvergente Evolutionsprodukte.
Die Unterschiede werden in der embryonalen Entwicklung deutlich: Das Wirbeltierauge wird als Teil des Gehirns angesehen, da seine erste Anlage aus diesem hervorgeht (Augenentwicklung (Wirbeltiere)). Dies ist zum Beispiel beim Kraken (Oktopus), der nicht zu den Wirbeltieren, sondern zu den Kopffüßern (Cephalopoden) zählt, nicht der Fall, bei dem das Auge evolutionär durch Einstülpung der äußeren Oberfläche entstanden ist. Der Entwicklungsvorgang beim Wirbeltier mit einer invertierten Retina (Abb. 8) hat mehrere Konsequenzen:
Erstens generiert der inwendig gebündelte, zum Gehirn führende Sehnerv einen blinden Fleck, da sich an der Stelle, wo er aus dem Auge austritt, keine lichtempfindlichen Sinneszellen befinden.
Zweitens liegen die Nervenfasern, Nervenzellen und Blutgefäße auf der zum Licht hin gerichteten Seite der Netzhaut, sodass das Licht diese durchqueren muss, bevor es die Fotorezeptoren erreicht. Drittens sind die langen Fotorezeptorfortsätze der Zapfen und Stäbchen nicht zur Lichtseite, sondern nach außen zum Pigmentepithel hin gerichtet.[28][29] Das Licht muss alle aufliegenden Schichten einschließlich der Fotorezeptoren durchqueren, bevor es auf deren lichtsensitive Außensegmente trifft (Abb. 8). Beim Oktopus gestaltet sich der Weg direkter; bei ihm trifft das Licht unmittelbar auf die Rezeptoren (Abb. 8).
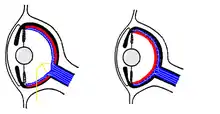
Diese Unterschiede waren immer wieder Gegenstand heftig geführter Diskussionen um die Perfektion des Auges und speziell darum, ob das Wirbeltierauge wegen der Inversionslage der Fotorezeptorzellen evolutionär unglücklich gebaut ist.[30] Da die Netzhautzellen sehr energiezehrend sind, müssen sie ausreichend mit Sauerstoff versorgt werden. Die ineffiziente Anordnung der Fotorezeptorzellen auf der inversen, lichtabgewandten Seite ist demnach unter dem Gesichtspunkt der Energieversorgung notwendig.[1] Es ist daher unangebracht, davon zu sprechen, das Wirbeltierauge sei unter dem hier betrachteten Aspekt „keineswegs perfekt“, „ungeschickt aufgebaut“, oder habe „bestimmte Mängel“, wie Trevor Lamb sich äußert.[31]
In der Evolution gibt es laut Julian Huxley und Ernst Mayr keine Perfektion.[32] Jedes Ergebnis kann immer nur im Zusammenhang mit den Umweltbedingungen der jeweiligen Art analysiert werden. Das Wirbeltierauge stand phylogenetisch demnach völlig anderen Umweltherausforderungen gegenüber als das Tintenfischauge. Ein Leistungs- oder Konstruktionsvergleich ist nicht möglich.
Farbsehen
Farbsehen evolvierte dadurch, dass Fotorezeptorzellen verschiedene Pigmente entwickelten.[25] Ein Fotorezeptorzellentyp ist stets auf eine bestimmte Wellenlänge des Lichts spezialisiert: Bei Menschen existieren Zapfen für kurzwelliges violettes Licht mit ca. 433 Nanometer (nm), für mittelwelliges, grünes Licht mit ca. 535 nm oder langwelliges, gelb-grünes, Licht mit ca. 560 nm. Andere Tiere haben spezielle Zapfen für das Farbsehen entwickelt. Für rotes Licht mit 625 nm existiert bei Säugetieren mit Ausnahme von Primaten kein Zapfen.
Echte Knochenfische, Reptilien und die aus ihnen hervorgegangenen Vögel unterscheiden dagegen vier Farben (tetrachromatisches Sehen),[33][34] Tauben sogar fünf. Vögel können im Gegensatz zum Menschen UV-Licht sehen. Sie leben aber nur relativ kurze Zeit, wodurch der Schaden dieses Lichts nicht zum Tragen kommt und der Vorteil klar überwiegt.
Bei Primaten mit längerer Lebenserwartung ist ein UV-Schutzmechanismus eingerichtet. Die Sehgrube im Augenhintergrund besitzt ein gelbes Pigment, das UV-Licht absorbiert.[7] Haie, Wale, Delfine und Robben sind farbenblind und besitzen nur einen grün-empfindlichen Zapfentyp. Stammesgeschichtlich zeigt sich aus dem Vierfarbensehen von Fischen und Vögeln, dass die gemeinsamen Vorfahren von Vierfüßern (Tetrapoden) und Tieren mit einer Embryonalhülle (Amnioten) bereits tetrachromatisch sahen und dies evolutionär bei Säugetieren teilweise wieder verloren ging.[35]
Die meisten Säugetiere haben nur noch zwei Zapfentypen (dichromatisches Sehen). Damit können sie zwischen violett, blau, grün und gelb unterscheiden, aber nicht ultraviolett, rot und orange; sie sind rot-grün farbenblind. Der Mensch hat einen dritten Zapfentyp neu entwickelt (trichromatisches Sehen).[36] Die Begründung für das wieder bessere Farbensehen der Primaten unter den Säugetieren wird in der Möglichkeit gesehen, Früchte zu erkennen. Eine andere, verhaltensorientierte Interpretation ist, Gefühlsregungen durch Änderungen der Gesichtsfarbe wahrnehmen zu können.[37]
Genetisch wurden bei den Primaten zwei unterschiedliche Wege für das trichromatische Sehen ausgebildet. Alle Primaten besitzen ein S-Opsin, für das ein autosomales Gen auf Chromosom 7 kodiert. Altweltaffen haben zwei benachbarte Gene auf dem X-Chromosom, die für das L- und M-Opsin kodieren.[36] Im Gegensatz dazu haben Neuweltaffen nur einen einzigen polymorphen Genlocus auf dem X-Chromosom für den Opsintyp M/L.[36] Daher ist jeder männliche Neuweltaffe dichromatisch, da er auf seinem X-Chromosom entweder nur das M- oder das L-Opsin zusätzlich zu dem S-Opsinpigment erhalten kann. Da der X-Chromosom Genlocus für das M- und L-Allel polymorph ist, sehen die heterozygoten Weibchen der Neuweltaffen trichromatisch, die homozygoten jedoch nur dichromatisch.[38]
Scharfsehen

Der Mensch sieht in unterschiedlichen Entfernungen scharf, indem er den Krümmungsradius der Linse ändert und auf diese Weise den Brennpunkt verschiebt (Abb. 9). Denselben Effekt erzielen Schlangen und Fische, indem sie den Abstand von der Linse zur Netzhaut verändern. Durch einen speziellen Muskel können Fische die Linse aus dem Ruhezustand, in dem sie vielfach auf nur 20 cm fokussiert ist,[20] nach hinten in Richtung zur Netzhaut ziehen. Sie verbessern dadurch die Fernsicht jedoch nur unwesentlich. Schlangen ziehen ihre Linse zur Fokussierung nach vorne. Schlangen besitzen kein Augenlid. Vielmehr ist die Augenoberfläche von einer transparenten Schuppe überzogen. Unterschiede herrschen ferner bei der Farbwahrnehmung.
Für optimiertes Scharfsehen entwickelten Greifvögel eine hochspezialisierte, neuromuskuläre Akkommodation. Hierbei passen feine Ziliarmuskeln die Wölbung der Linse an wechselnde Objektentfernungen an. Im Weiteren entwickeln Greifvögel neben der Fovea centralis eine zweite, seitliche Sehgrube in der Retina.[39] Hier liegt wie in der zentralen Sehgrube eine Verdichtung von Zapfen vor.
Viele kleine Lebewesen mit kleinen Augen sind im direkten Sonnenlicht aktiv. Sie benötigen keinen speziellen Fokussiermechanismus, da bei ihnen die Irisöffnung klein ist, was einer großen Tiefenschärfe gleichkommt.
Das menschliche Auge
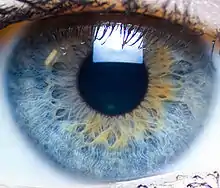
Der Mensch ist überzeugt, Objekte zu sehen, wie sie wirklich sind. Das ist nicht der Fall. Wie jedes Tier nimmt der Mensch eine ökologische Nische ein, für die seine Sehfähigkeit adaptiert ist. Wir sehen Dinge, die wir gemäß unserer evolutionären Entwicklung sehen müssen, andere sehen wir nicht. Einerseits verfügen wir im Vergleich zu anderen Wirbeltieren über ausgezeichnetes Scharfsehen, Akkomodationsfähigkeit, Fernsicht und räumliche Sicht und können auch gegenüber den meisten Säugetieren trichromatisch sehen. Demgegenüber ist das menschliche Farbsehen auf ein außergewöhnlich enges Lichtspektrum beschränkt; UV-Licht sehen wir gar nicht.[40] Bei Jungen werden acht Prozent farbenblind geboren.[7]
Der Anteil blauer Zapfen in der Netzhaut ist sehr gering. Zudem sind die Signale der blauen Zapfen sehr schwach und werden um 30 Millisekunden langsamer verarbeitet als die roten und grünen Signale, was vom Gehirn korrigiert werden muss.[41] Auch ist das menschliche Sehen wie das vieler Tiere auf bewegte Objekte adaptiert. Längere unbewegte Objekte verschwinden aus dem Gesichtsfeld, was Sakkadierungstests, ruckartige Augenbewegungen synchronisiert mit Objektbewegungen, bestätigen.[42] Ebenso nehmen wir Gegenstände, die in das Sehfeld treten, während wir uns auf ein Objekt konzentrieren, nicht oder nur eingeschränkt wahr.[43]
Lösungen zur Nachtsichtfähigkeit
Wirbeltieraugen müssen spezifischen Anforderungen genügen, etwa für die Wahrnehmung bei Dunkelheit (Katzen, Nachtvögel) oder ein scharfes Sehen in großer Entfernung (Greifvögel). Insbesondere Katzen, aber auch Hunde, Pferde und Rinder haben beispielsweise als Restlichtverstärker für eine erhöhte Nachtsichtfähigkeit eine retroreflektierende Schicht hinter oder inmitten der Netzhaut entwickelt, das Tapetum lucidum (Spiegelauge) (Abb. 11).[44]
Auch die Augengröße selbst ist eine Variationsform der Evolution zur Verbesserung der Nachtsichtfähigkeit. So haben relativ zur Körpergröße Koboldmakis (Tarsiidae), eine kleine südostasiatische Primatenfamilie, die größten Augen unter allen Säugetieren.[45] Der starr im Kopf liegende Augapfel hat einen Durchmesser von rund 16 Millimetern und ist damit größer als das Gehirn und bei einer Körperlänge von nur 9–11 cm sogar geringfügig größer als der des Menschen. Die Augen sitzen in Orbitatrichtern, die ähnlich den Augenhöhlen der Affen gebaut sind.
In der Tiefe lebende Fische lösten das Problem des Sehens in Dunkelheit ergänzend zu einer Spiegelschicht dadurch, dass bei ihnen bis zu zwölf Lagen von Sehzellen übereinander angeordnet sind. Zusätzlich sind bei ihnen Doppelzapfen vorhanden, was die Rezeptordichte erhöht.[20] Eine weitere Lösung für Nachtsicht haben Geckos evolviert. Sie haben die Stäbchen in ihren Augen verloren und können daher als einzige Tiere nachts mit den Zapfen sehen.[46]
Lösungen zur Weitsichtfähigkeit bei Vögeln
Bei Greifvögeln treten andere Entwicklungsunterschiede hervor. Ihre Augen sind verhältnismäßig groß, was einen hohen Lichteinfall und damit ein großes Abbild des Sehobjekts auf der Retina und im Gehirn ermöglicht. Die großflächigere Aufteilung des fixierten Objekts auf eine höhere Anzahl von Netzhautzellen führt zu einem detailreicheren Bild. Die Augen der Greifvögel werden auf der Kopfvorderseite, also frontal ausgebildet, was die gleichzeitige Wahrnehmung eines Objekts mit beiden Augen ermöglicht. Gestattet diese Anordnung binokulares Einfachsehen, ist dies, wie beim Menschen die Voraussetzung für räumliches Sehen.
Alle Vögel verfügen über einen kammartigen Augenfächer innerhalb des Glaskörpers, den Pecten oculi.[47] Diese mit engen Kapillaren durchzogene Struktur sorgt für eine verstärkte Durchblutung und Nährstoffversorgung der Netzhaut.
Unabhängige Augen, Gleitsicht, Sehen nur bewegter Objekte
Chamäleons entwickeln mehrere herausragende Eigenschaften ihrer Augen. Diese sind voneinander unabhängig beweglich. Man vermutet, dass es zu einer unabhängigen und getrennten Verarbeitung der Informationen beider Augen im Gehirn kommt. Chamäleons erzielen ferner durch die kleine Augenöffnung einen zusätzlichen Lochkameraeffekt, der es ihnen erlaubt, auf einen Kilometer scharf zu stellen (Abb. 15). Ihre Fokussiergeschwindigkeit ist etwa viermal schneller als die des Menschen.[48]
Weitere Besonderheiten bei Wirbeltieraugen sind die kugelförmige, im Ruhezustand auf kurze Distanz fokussierte Linse bei Fischen, multifokale Linsen bei manchen Katzenarten, die Schrägstellung der Netzhaut zur Linse bei Pferden, was einen Gleitsichteffekt bewirkt oder die schützende Nickhaut bei Fröschen, Vögeln und Hunden, rudimentär auch im nasenseitigen Augenwinkel beim Menschen.[20] Frösche können ein Objekt erst erkennen, wenn sein Abbild über die Netzhaut wandert.
Sehr rudimentäre Freund-Feind-Muster besitzen Kröten. Sie erkennen ein längliches, sich bewegendes Objekt erst als Beute, wenn es sich entlang seiner Längsachse bewegt und als Feind, wenn es sich quer zu dieser bewegt.[49] Evolution und Genetik der hier beschriebenen Augenkomponenten und -unterschiede bei Wirbeltieren sind erst wenig erforscht.
 Abb. 11 Retroreflexion bei Katzenaugen durch das Tapetum lucidum auf der Netzhaut
Abb. 11 Retroreflexion bei Katzenaugen durch das Tapetum lucidum auf der Netzhaut Abb. 12 Vierauge mit geteilt wirkenden Augen für gleichzeitiges, gleich gutes Über- und Unterwassersehen
Abb. 12 Vierauge mit geteilt wirkenden Augen für gleichzeitiges, gleich gutes Über- und Unterwassersehen Abb. 13 Höckerschildkröte – horizontale Zentrallinie der Augen bei Blickrichtung nach vorne
Abb. 13 Höckerschildkröte – horizontale Zentrallinie der Augen bei Blickrichtung nach vorne Abb. 14 Höckerschildkröte – horizontale Zentrallinie der Augen bei Blickrichtung nach oben (selbes Individuum wie in Abb. 13)
Abb. 14 Höckerschildkröte – horizontale Zentrallinie der Augen bei Blickrichtung nach oben (selbes Individuum wie in Abb. 13) Abb. 15 Chamäleonaugen können sich in großem Radius unabhängig voneinander bewegen.
Abb. 15 Chamäleonaugen können sich in großem Radius unabhängig voneinander bewegen.
Über- und Unterwasser-Fokussierung
Eine große Herausforderung stellt die Anpassung an Augen der Wirbeltiere, die sowohl unter als auch über Wasser gut sehen müssen, wie etwa das Vierauge (Abb. 12). Seine Hornhaut entwickelt sich zweigeteilt: Die obere Hälfte ist stark gekrümmt für das Sehen über Wasser, die untere Hälfte nur sehr schwach gekrümmt für das Sehen unter Wasser. So wird der unterschiedlichen Brechkraft von Luft und Wasser Rechnung getragen und gleichzeitiges gutes Sehen in Luft und Wasser möglich. Auch die Netzhaut des Vierauges entwickelt sich zweigeteilt. Die für das Sehen in der Luft zuständige Seite hat doppelt so viel Zapfen wie die für das Sehen im Wasser.[20]
Einige Wasserschildkröten, darunter die Falsche Landkarten-Höckerschildkröte (Graptemys pseudogeographica), können ihre Augen um eine gedachte Achse drehen, die die Pupillen verbindet (Abb. 13 und Abb. 14). Die Zentrallinie der Augen bleibt dadurch meist auf den Horizont ausgerichtet, auch wenn das Tier nach oben oder unten schwimmt und dabei in Schwimmrichtung blickt. Auf der Ebene der schwarzen Zentrallinie hat die Netzhaut die höchste Rezeptorendichte, somit ist das dicht am Boden oder im Wasser lebende Tier für das Sehen entlang der Horizontallinie am besten angepasst. Koordiniert wird diese einmalige Entwicklung vermutlich durch den Gleichgewichtssinn im Gehirn (Vestibularorgan), der spezifische Augenmuskeln dafür steuert.[50]
Wanderndes Auge bei Plattfischen
Einmalig bei Wirbeltieren ist die Wanderung eines der beiden Augen bei Plattfischen. Hierbei kann ein Auge während des frühen Wachstums an der Rückenflosse vorbei oder durch deren Basis hindurch auf die spätere obere Körperseite wandern. Die Wanderung kann sowohl auf die linke Seite (Steinbutt) als auch auf die rechte Seite (Scholle, Seezunge) verlaufen.[20]
Evolution des Facettenauges
Das Facettenauge oder Komplexauge der Insekten und Krebstiere, dem Stamm der Arthropoden, ist eine evolutionäre Abwandlung des Linsenauges. Beiden gemeinsam ist das Mastergen Pax6 für die Augeninduktion.
Die Verpflanzung der Pax6-Version small eye der Maus in die Taufliege durch das Team von Walter Gehring führte dort zur ektopischen Augenbildung auf den Beinen oder Antennen, was die Verwandtschaft und Konservierung dieses augeninduzierenden Gens in der Evolution beider Stämme bewies.[51]
Das Facettenauge besteht bei der Honigbiene aus 5.000 und bei Libellen aus bis zu 30.000 linsenbestückten Einzelaugen, den Ommatidien, die im Zusammenwirken ein scharfes Bild erzeugen (Abb. 16). Facettenaugen sind besonders große, kugelförmige Augen mit einer Reihe von evolutionären Vorteilen. Das zeitliche Auflösungsvermögen beträgt bis zu 300 getrennte Bildern pro Sekunde und damit etwa eine um zehnmal häufigere Einzelbilderzeugung als beim Menschen mit 30 Bildern pro Sekunde, was zu einer schnelleren Reaktion führt. Das Blickfeld ist durch die kugelförmig angeordneten Facetten weiter und ermöglicht eine gute Rundumsicht. Alle Einzelaugen erreichen im Nahbereich die gleiche Auflösung, während eine scharfe Abbildung beim Wirbeltier nur in der Bildmitte erfolgt.[20] Facettenaugen haben evolutionär mehrere Spezialformen ausgebildet, darunter das Appositionsauge, mit einer Abschirmung der einzelnen Ommatiden, was die Nachtsicht verbessert. Das Superpositionsauge zeigt nur eine partielle Abschirmung nicht auf der ganzen Länge der Ommatiden.
Das höchstentwickelte Facettenauge ist das der Honigbienen. Bei ihnen ist relativ zu anderen Insekten der Abstand der Linse eines Ommatidiums von seinem Fotorezeptor größer.[7] Sie nehmen die Grundfarben gelb, blau und ultraviolett wahr; scharlachrot (dunkelrot) erscheint ihnen schwarz. Landschaft sehen die Bienen in hellgrau, so dass sich die Blüten besser abheben als für den Menschen. Weiße Blüten gibt es für die Bienen nicht, sie reflektieren stets ultraviolett und dabei auch Strukturen. Das sichtbare Spektrum liegt bei ca. 300–650 nm, das entspricht ultraviolett bis dunkelrot.
Die ältesten fossil belegten Facettenaugen bestehen aus wenigen Ommatidien und stammen von Trilobiten und kleinen, in Orsten konservierten Arthropoden aus Burgess-Schiefer Fossillagerstätten, deren Alter zwischen 520 und 500 Millionen Jahre beträgt. Die ältesten großen Facettenaugen mit jeweils mehr als 3000 Ommatidien sind 515 Millionen Jahre alt und wurden auf Kangaroo Island, Australien, geborgen.[52] Die Evolution schlug mit dem Facettenauge eine sehr aufwändige Entwicklung ein, die zum Beginn des Kambriums das Tierreich einige Millionen Jahre beherrschte. Das Auge ist nur im Nahbereich zu Scharfsicht fähig; für Scharfsehen auf weitere Distanz fehlt den einzelnen Ommatidien optisch die erforderliche Größe und für gutes räumliches Sehen die bessere Überlappung der Einzelbilder.[7]
Die evolutionäre Festlegung auf einen Augentyp kann in der Regel nicht mehr geändert werden, da die komplexen genetischen Komponenten und embryonalen Entwicklungspfade festgelegt bzw. kanalisiert sind. Zu den seltenen Ausnahmen für einen Wechsel des Augentyps bei Trägern von Facettenaugen gehören die Springspinnen, die Linsenaugen besitzen und bestimmte Insektenlarven.[20]
Ökologische Nischen für alle Augentypen bei rezenten wirbellosen Tieren
Alle Augentypen, einfach bis hochentwickelte, kommen bei rezenten wirbellosen Tieren vor. Jedes Auge ist eine Optimierung einer Reihe verschiedener Fitnesskriterien, wiedergegeben durch einfache bis komplexe Verhaltensformen, die durch entsprechende Augentypen möglich werden.
In der ungefähren Reihenfolge zunehmender Anforderungen für die evolutionäre Realisierung der Eigenschaften und zunehmender Informationsgewinnung durch das Sehen unterscheidet Nilsson hier: Sehen mit geringer Lichtempfindlichkeit, Schattenerkennung, zunehmende Helligkeitsdifferenzierung, Richtungssehen, Farbsehen, Scharfsehen, zunehmende Geschwindigkeit der Informationsverfügbarkeit im Gehirn, zunehmende Abbildungshäufigkeit pro Zeiteinheit und hohe Bildauflösung.[17]
Hauptsächlich erfolgt jedoch eine evolutionäre Abwägung zwischen hoher Lichtempfindlichkeit ohne Linse und hohem Auflösungsvermögen mit großer Linse, großer Netzhautoberfläche und entsprechendem Gehirn. Für jede der vielen Vorteilskombination existieren ökologische Nischen, an die die Tiere mit unterschiedlichen Augen jeweils gut visuell adaptiert sind.
Zusätzliche Einfachaugen bei Gliederfüßern und Insekten
Gliederfüßer können zusätzlich zu ihren Komplexaugen Augenflecken (Ocelli), punktförmige Einzelaugen am Kopf besitzen (Abb. 17 und Abb. 18). Zu den Vertretern mit einfachen Flachaugen zählen Quallen und Seesterne. Strudelwürmer und Lanzettfischchen besitzen Pigmentbecheraugen (Abb. 19). Linsen- und hornhautlose Lochkameraaugen finden sich bei der Familie der Perlboote (Nautilus) (Abb. 20).
Viele Augen für Rundumsicht bei Springspinnen
Springspinnen (Abb. 21) besitzen Haupt- und Nebenaugen. Die Hauptaugen sind ein für Gliederfüßer sehr hoch entwickelter Sehsinn, der ein erweitertes Spektrum bis ins Ultraviolette zulässt.[53] Die Nebenaugen sind seitlich am Kopf bis zum Hinterkopf angeordnet, so dass die Spinne auch nach hinten schauen kann.
Vier Sehzellentypen (Tetrachromat) kommen vor, die zudem auch sehr zahlreich sind. Die stark vergrößerten und nach vorne ausgerichteten Hauptaugen besitzen große Glaskörper, was eine lange Brennweite erzeugt. Die Linse fokussiert auf die vier untereinander liegenden Netzhautschichten in Abhängigkeit von der Wellenlänge des Lichtes. Die unterste und die darüberliegende Netzhaut sind grün-empfindlich. Das Grünbild wird jedoch nur auf der untersten scharf dargestellt. Der Unschärfeunterschied zwischen diesen beiden Netzhäuten erlaubt eine Entfernungsbeurteilung.[54]
Springspinnen können mit bestimmten Augenpaaren einen Gegenstand fixieren, während sie gleichzeitig mit anderen Augen diesen genauer abtasten. Auch können sie räumliches Sehen realisieren, dadurch dass Haupt- und Nebenaugen überlappende Bilder erzeugen. Springspinnen sehen auf kurze Distanz besser als der Mensch. Im Gegensatz zu anderen Spinnen, die ihre Beute bei Vibration im Netz ertasten, erkennen Springspinnen ihre Beute visuell.[20]
 Abb. 17 Triops, Krebs mit zwei nierenförmigen Komplexaugen und einem Ocellus dazwischen
Abb. 17 Triops, Krebs mit zwei nierenförmigen Komplexaugen und einem Ocellus dazwischen Abb. 18 Stirnocellen bei einer Hornisse
Abb. 18 Stirnocellen bei einer Hornisse Abb. 19 Pigmentbecherauge der Napfschnecke
Abb. 19 Pigmentbecherauge der Napfschnecke.jpg.webp) Abb. 20 Perlboot Nautilus pomilius mit Lochkameraauge ohne Linse und Hornhaut
Abb. 20 Perlboot Nautilus pomilius mit Lochkameraauge ohne Linse und Hornhaut Abb. 21 Springspinne mit großen linsenbestückten Hauptaugen und mehreren äußeren Nebenaugen rund um den Kopf
Abb. 21 Springspinne mit großen linsenbestückten Hauptaugen und mehreren äußeren Nebenaugen rund um den Kopf Abb. 22 Sepiaauge mit gezackter Pupille für die gleichzeitige Fokussierung des Lichts an zwei Stellen auf der Netzhaut
Abb. 22 Sepiaauge mit gezackter Pupille für die gleichzeitige Fokussierung des Lichts an zwei Stellen auf der Netzhaut Abb. 23 Die Jakobsmuschel hat bis zu hundert einfache Augen
Abb. 23 Die Jakobsmuschel hat bis zu hundert einfache Augen
Große Augendiversität bei Weichtieren
Die Augen von Weichtieren (Mollusca) evolvierten sieben bis elfmal.[55] Dabei entstand eine große Diversität an Augentypen, die alle Komplexitätsstufen umfasst, vom Grubenauge vieler Schnecken (Gastropoden), über das Lochkameraauge des Nautilus bis zum hochentwickelten Linsenauge der Kopffüßer (Cephalopoden).
Die Würfelqualle Chironex fleckeri hat acht Linsenaugen, acht schlitzförmige Augen und acht linsenlose Sehgruben, 24 Augen insgesamt, die nicht mit einem Zentralgehirn, sondern einem dezentralen Nervensystem verbunden sind.[7] Die Informationsverarbeitung der eingehenden Lichtsignale ist nicht geklärt. Das Auge der Sepien und des Oktopus ist stark vom Kopf erhöht, hat ein überschneidendes Sehfeld und volle Rundumsicht. Der Krake ist farbenblind. Manche Tintenfische können Farben sehen. Die Besonderheit des Auges der Sepien ist eine schräg liegende, w-förmige Pupille, wodurch zwei getrennte Stellen auf der Netzhaut in den Lichtfokus gelangen (Abb. 22). Er kann so seitlich und nach vorne gleichzeitig scharf sehen.[20]
Das größte Auge in der Tierwelt besitzt der Koloss-Kalmar. Es hat mit bis zu 30 cm Durchmesser mehr als die Größe eines Fußballs. Die Linse hat die Größe einer Orange. Die evolutionäre Notwendigkeit für die Entwicklung eines so großen Auges, das viel Energie beim Stoffwechsel benötigt, liegt wahrscheinlich nicht im Ermöglichen, Beute im Dunkeln großer Wassertiefe finden zu können, denn das gelingt auch dem Schwertfisch mit kleineren Augen. Vielmehr sieht Nilsson den Grund darin, dass ein evolutionäres Wettrüsten (Koevolution) zwischen dem Kalmar und dem Pottwal, ihren größten Feinden, entstand. Dabei ortet der Pottwal seine Beute durch Schall, während der Kalmar mit den großen Augen in einer Tiefe von 500 Metern bei wenig Licht Wale auf eine Entfernung von bis zu 120 Metern erkennen und auf Abstand halten kann.[56][57]
Facettenaugen sind bei manchen Muscheln (Bivalvia) präsent, und Spiegelaugen als reflektierende 'Spiegel' evolvierten in anderen Taxa, etwa bei der Jakobsmuschel (Abb. 23).[58] Auch in den Augen der Kammmuschel (Pecten) wird das Bild durch Hohlspiegel erzeugt, die hinter der Netzhaut angeordnet sind. Die direkt vor der Netzhaut liegende Linse dient der optischen Korrektur des stark verzerrten Spiegelbildes. Die Spiegel sind nach dem Prinzip von reflektierenden Glasplatten gebaut. Mehr als 30 Schichten aus feinsten Guanin-Kristallen liegen dicht gestapelt, jede Schicht in eine Doppelmembran eingeschlossen. Weitere Tiere haben Spiegelaugen, unter anderem der Tiefseekrebs Gigantocypris, Hummer und Langusten. Diese Form hat sich offenbar dort durchgesetzt, wo es weniger auf die Bildqualität und mehr auf die Lichtausbeute ankommt. Die Augen von Weichtieren umspannen außerdem eine beachtliche Größenbandbreite. Sie variieren von 20 µm bis 27 cm.[58]

Das komplizierteste Auge im Tierreich bei den Fangschreckenkrebsen
Eine der kompliziertesten Augenkonstruktionen im Tierreich ist die der Fangschreckenkrebse, einer Ordnung der Gliederfüßer (Arthropoda) mit etwa 400 Arten. Ihr Facettenauge, ein Stielauge, ist in der Grundstruktur dreigeteilt (Abb. 24). Schon dadurch ist es eine einzigartige Bauform. Die Sehfelder des oberen und des unteren Abschnitts überlappen sich und sind durch die Form des Auges bedingt.
Dies ermöglicht separates räumliches Sehvermögen mit jedem Komplexauge. In der Mitte verläuft ein horizontales Querband, das aus sechs hochspezialisierten Ommatidenreihen besteht. Mit diesen kann das Tier 100.000 Farben, darunter auch UV-Licht sehen. Dafür besitzt es sechzehn Arten von Farbrezeptoren. Kein Tier sieht mehr Farben. Zudem kann der Krebs Licht polarisiert wahrnehmen.[59] Das Sichtfeld des Ommatiden-Sensors beträgt nur 10–15 Grad. Da die beiden Augentypen, Facettenauge und Ommatidenbänder, unabhängig bewegbar sind, kann der Krebs das Facettenauge zur Fixierung der Form verwenden und gleichzeitig mit den Ommatiden Details wie Farbe und Polarisation erkennen und abtasten. Die hohe Farbvisualisierung sowie die gleichzeitige Polarisationsfähigkeit geben verschiedene evolutionäre Erklärungsmöglichkeiten: Die hohe Farbsichtfähigkeit wird mit sexueller Selektion erklärt. Der Krebs ist ein auffallend buntes Tier. Farben haben im Tierreich häufig sexuelle Funktion. Fangschreckenkrebse regeln ihre Beziehungen zu Artgenossen durch Imponiergehabe und Tänze.[60] Zudem fluoreszieren die Weibchen in der Paarungszeit. Die Männchen erkennen die Wellenlänge.[61]
Farberkennung und Sexualverhalten sind so als parallele Evolutionen erklärbar. Die Polarisierung erlaubt Kommunikation mit Artgenossen oder dem Geschlechtspartner, ohne dass Räuber diese Kommunikation wahrnehmen. Die evolutionäre Realisierung hierfür erfordert nur wenige Änderungen in Zellen und ist leicht selektierbar.[62]
Masterkontrollgene und Genregulationsnetzwerke für das Auge
1995 wurde von Walter Gehring das Gen Pax6 entdeckt[51]. Es nahm schnell eine extreme Sonderstellung als das Masterkontrollgen für die Evolution und Entwicklung aller Augentypen ein. Ein Masterkontrollgen stößt die Expression weiterer Gene an, das können im Fall des Auges mehrere hundert sein. Ferner können nachgelagerte Induktionen folgen, die wieder mit neuen Mastergenen beginnen und eine weitere Kette von Genexpressionen nach sich ziehen oder Genregulationsnetzwerke auslösen.
Bei Pax6 unterbleibt einerseits ohne die Expression eine Augenentwicklung vollständig. Anderseits lassen sich durch Pax6 bzw. sein homologes Gen Eyeless ektopische Augen auf dem Bein oder der Antenne der Taufliege (Drosophila melanogaster) anstoßen[51]. Gleiches gelang später ansatzweise beim Wirbeltier[63], unter anderem beim Hühnchen (1995)[64] oder mittels Sox3 beim Krallenfrosch (Xenopus laevis) (2000)[65].
In diesen Versuchen kam es zur Herausbildung ektopischer Linsen oder Plakoden. Dass die Versuche nicht zu so vollständigen Ergebnissen geführt haben wie bei der Fruchtfliege, lässt auf die höhere Komplexität der Wirbeltiere schließen. In jedem Fall unterbleibt die Augenentwicklung beim Wirbeltier gänzlich, wenn Pax6 unterdrückt wird.
Diese Sonderstellung muss nach 20 Jahren neu beurteilt werden. Für die Besonderheit von Pax6 als Mastergen spricht erstens, dass es einerseits früh, nämlich bereits in Augenstammzellen, andererseits in vielen Geweben während der gesamten Augenentwicklung exprimiert wird, und zwar bei der Fruchtfliege, bei Mensch und Tintenfisch. Bei diesen Arten aus verschiedenen Tierstämmen wird die Augenentwicklung als unabhängig angenommen. Pax6 kann daher seit einem gemeinsamen Vorgänger als konserviert gelten. Zweitens führt die Reduzierung seiner Expression zu einer verminderten Augengröße bei Drosophila, Maus und Mensch. Drittens kann Pax6-Fehlexpression in bestimmten Geweben, z. B. im Drosophilaflügel oder -bein ektopische Augen hervorrufen.
Gegen eine herausragende oder gar alleinige Mastergenstellung von Pax6 in der Augenevolution sprechen die folgenden Fakten:
Erstens führt die Eliminierung von Pax6 bzw. die des homologen Gens Eyeless bei Drosophila, das ebenfalls zur Pax6-Familie zählt, nicht allein zum Verlust des Auges, sondern auch von weiteren Gehirnteilen, im Extremfall bei Drosophila zum totalen Kopfverlust[66].
Zweitens nehmen weitere Gene neben Pax6 Schlüsselstellungen bei der frühen Augenentwicklung ein, so etwa neben den genannten Rx1 und Sine oculis (Six)[67] auch Eyes absent (Eya)[68] oder Dachshund (Dach)[69].
Diese Gene können ebenfalls ektopische Augen induzieren. Ihr Funktionsverlust führt ebenfalls zum Verlust des Auges. Sie zeigen somit ähnliche Masterkontrollgen-Eigenschaften wie Pax6. Die stammesübergreifenden Charakteristika von Pax6 werden im Vergleich zu den Fähigkeiten anderer Mastergene heute relativiert. Es muss nach dem gegenwärtigen Stand der Wissenschaft von der evolutionären Konservierung des Regulationsnetzwerks einer ganzen Gruppe von Genen gesprochen werden[14], die verantwortlich am Beginn der Kette der Evolution des Auges stehen.
Kontroverse: Ein- oder mehrmaliges Entstehen des Auges
Nach der noch heute verbreiteten Lehre des Evolutionstheoretikers Ernst Mayr ist das Auge in der Evolution mehr als 40 Mal völlig unabhängig voneinander entstanden.[13]
Neuere Studien sprechen von 50- bis 100facher Evolution des bilderzeugenden Auges.[70][15]
Dieser These zufolge hat das Wirbeltierauge eine andere evolutionäre Herkunft als etwa das Facettenauge des Insekts, das Lochauge urtümlicher Kopffüßer oder andere Augentypen. Genauer betrachtet zeigt sich heute, dass einerseits der genetische Ursprung aller Augentypen, die Genregulationsnetzwerke, auffallend gleich sind, was für eine homologe, also abgeleitete Entstehung der Augentypen spricht. Ein sehr starker Hinweis auf die einmalige Entwicklung des Auges ist das PAX6-Gen, welches in verschiedensten, entfernt verwandten Tierarten (Insekten, Amphibien, Säugetiere und Mollusken, generell alle Bilateria) beim Embryo die Entwicklung des Sehorgans einleitet. So kann die Ausschaltung des Gens in der Fruchtfliege – und das Einsetzen des analogen Gens des Krallenfrosches – den normalen Phänotyp retten; die Augen der Fliegen entwickeln sich somit normal.
Andererseits unterscheiden sich die „Konstruktionen“, also die kombinierte Verwendung aller beteiligten Gene und die Reihenfolge ihrer Aktivierung und damit auch die Entwicklungspfade stark voneinander. Es entstanden unterschiedliche Gewebearten und Funktionseinheiten. Somit kann die Evolution des Auges im Sinne Mayrs zumindest in Teilaspekten durchaus auch als unabhängig oder konvergent gesehen werden.[71]
Heute werden demnach zwei unterschiedliche Standpunkte der Augenevolution diskutiert.
Auf der einen Seite steht die Ansicht, dass das Auge einen gemeinsamen Vorgänger besitzt, das heißt, es hat einen monophyletischen Ursprung. Seine ähnlichen Komponenten, etwa beim Wirbeltier und Insekt, sind danach homolog vererbt. Vor allem die phänotypischen Ergebnisse gemeinsamer Genkaskaden sind nach dieser Auffassung homolog, also in Abhängigkeit von einem gemeinsamen Vorfahren entstanden. Dies ist allerdings nicht zwingend. Auch wenn es naheliegt, dass zum Beispiel ähnliche Fotorezeptoren homolog entstanden sind, muss dies nicht immer der Fall sein.[72] Die homologe Herkunft des Auges ist die Sichtweise von Walter Gehring[73] und Kollegen. Es war die Gruppe um Gehring, welche in den 1990er Jahren das PAX6-Gen und seine Bedeutung beschrieben hatte.
Auf der anderen Seite wird heute auch die Auffassung vertreten, das Auge habe polyphyletische Ursprünge, wobei die ähnlichen Eigenschaften (Linse, Netzhaut, Fotorezeptoren etc.) unabhängig voneinander erworben worden sind.[71]
Diese Erkenntnis wurde neuerdings möglich auf Grundlage der Analyse von Würfelquallen-Augen (Tripedalia cystophora)[74][72], einem Quallentyp mit 24 Augen rund um den quadratischen Schirm (Meduse). Dieses Quallenauge besitzt Linse, Hornhaut und Netzhaut. Die Quallen stehen systematisch weit entfernt vom Wirbeltier und seinen nächsten Vorfahren. Die Würfelqualle besitzt zwar trotz ihrer kladistischen Entfernung vom Wirbeltier einen ziliaren Fotorezeptortyp, bei dem das Sehpigment in die Oberfläche eines Wimpernhärchens eingelagert ist, sowie ein zum Wirbeltier vergleichbares Übertragungssystem für die Weiterleitung von Lichtsignalen, was beides für Homologie spricht.
Jedoch sind die wichtigsten Kristalline, die für die optischen Eigenschaften der Linse verantwortlich sind, auf andere Art entstanden als beim Wirbeltier, also konvergent. Die Frage nach der ein- oder mehrmaligen Entwicklung des Auges ist letztlich abhängig von der Definition des Auges und der Betrachtungsebene. Für das Vorhandensein von Homologie in der Biologie existieren klare Kriterien. Die Frage kann daher nicht allgemeingültig mit „homolog“ oder „konvergent“ beantwortet werden. Mit größter Wahrscheinlichkeit steht das Beispiel Linsenevolution (Kap. 4) für mehrfache Konvergenz in der Augenevolution.
Literatur
- Walter J. Gehring: Entwicklung und Evolution der Augen in: Das Basteln der Evolution. Walter J. Gehring erzählt eine genetische Theorie der Entwicklung. supposé Berlin 2014
- Georg Glaeser und Hannes F. Paulus: Die Evolution des Auges. Springer-Spektrum 2014
- Simon Ings: Das Auge. Meisterstück der Evolution. Hoffmann und Campe Hamburg 2008
- Trevor D. Lambs: Das Auge – Organ mit Vergangenheit in: Evolution. Wie sie die Geschichte des Lebens geformt hat. Spektrum der Wissenschaft Spezial 1/2014.
- Gerald H. Jakobs und Jeremy Nathans: Der merkwürdige Farbensinn der Primaten in: Evolution. Wie sie die Geschichte des Lebens geformt hat. Spektrum der Wissenschaft Spezial 1/2014.
Weblinks
- Afrikas Licht beeinflusste unsere Augenevolution
- David Attenboruough: The evolution of the eye
- Eye evolution (youtube) (Unterschiede bei Vertebraten)
- Richard Dawkins demonstrates the evolution of the eye (youtube)
- Seestern oder Sehstern? (Wissenschaft aktuell 5. Juli 2013)
- The evolution of the eye (Richard Dawkins, 2010; youtube)
- The New York Academy of Science Magazine: How the Eye evolved (Carl Zimmer), Oct. 2009
- Urahn der blauen Augen – Trendfarbe der Evolution
- Wenn die Evolution ins Auge geht (Welt.de)
- Wenn Evolution ins Auge geht. Vom Fotorezeptor zum Linsenauge
- Wozu der Riesenkalmar kürbisgroße Augen hat
Einzelnachweise
- Nick Lane: Leben. Verblüffende Erfindungen der Evolution. Primus Verlag 2013
- Andrew Parker: In the Blink of an Eye. Free Press 2003
- Unique system of photoreceptors in sea urchin tube feet. Esther M. Ullrich-Lüter, Sam Dupont, Enrique Arboleda, Harald Hausen and Maria Ina Arnone. Proceedings of the National Academy of Sciences. PNAS May 2, 2011
- Charles Darwin: Die Entstehung der Arten. Nikol Hamburg 2008, Kap. 6
- Ramon y Cajal: Die Retina der Wirbeltiere. Bergmann 1894
- Gordon Lynn Walls: The Vertebrate Eye and its Adaptive Radiation. The Cranbrook Institute of Science, Bloomington Hills, Michigan; online on openlibrary: The Vertebrate Eye and its Adaptive Radiation by Gordon Walls
- Simon Ings: Das Auge'. Meisterstück der Evolution. Hoffmann und Campe Hamburg. 2008. Orig.: The Eye: A Natural History, Bloomsbury, 2007, ISBN 978-0-7475-7805-5
- The molecular basis of visual excitation. Les Prix Nobel en 1967, hg. v. R. Granit, Stockholm Nobelstiftung
- George Wald: The Origins of Optical Activity, Ann. NY Acad. Sci., 1975
- Nathans J et al. Jeremy Nathans, D. Thomas, D. S. Hogness: Molecular genetics of human color vision: the genes encoding blue, green, and red pigments. In: Science. 232, Nr. 4747, April 1986, S. 193–202. doi:10.1126/science.2937147. PMID 2937147.
- Gerald H. Jacobs, Jeremy Nathans: Der merkwürdige Farbensinn der Primaten. In: Spektrum der Wissenschaft. 5/2010. 23. April 2010, S. 44–51, abgerufen am 23. Mai 2015.
- Walter Gehring: Historical perspective on the development and evolution of eyes and photoreceptors. The International Journal of Developmental Biology, 48, S. 707–717, 2004
- Ernst Mayr: Das ist Evolution. Goldmann 2005, S. 250ff
- Michael E. Zuber, Gaia Gestri, Andrea S. Viczian, Giuseppina Barsacchi and William A. Harris. Specification of the vertebrate eye by a network of eye field transcription factors. Development 12/2003, 130, 5155-5167
- M. F. Land, Dan-Erik Nilsson: Animal Eyes, Oxford University Press, Oxford (2002)
- Publikationen von Nilsson
- Dan-Erik Nilsson: Eye evolution and its functional basis. Visual Neuroscience (2013), 30, 5-20
- D. Arendt, K. Tessmar-Raible, H. Snyman, A.W. Dorresteijn, J. Wittbrodt: Ciliary Photoreceptors with a Vertebrate-Type Opsin in an Invertebrate Brain. In: Science. 306, Nr. 5697, 29. Oktober 2004, S. 869–871. doi:10.1126/science.1099955. PMID 15514158.
- Trevor D. Lamb, Shaun P. Collin, Edward N. Pugh Jr.: Evolution of the vertebrate eye: opsins, photoreceptors, retina and eye cup. Nature Reviews, 8, 2007, 960-975
- Georg Glaeser u. Hannes F. Paulus. Die Evolution des Auges. Springer-Spektrum 2014
- Dan-Erik Nilsson (1996). "Eye ancestry: old genes for new eyes". Current biology : CB 6 (1): 39–42. doi:10.1016/S0960-9822(02)00417-7. PMID 8805210
- IR Schwab: You are what you eat. In: BMJ Group (Hrsg.): British Journal of Ophthalmology. 88, Nr. 9, September 2004, S. 1113. doi:10.1136/bjo.2004.049510. PMID 15352316. PMC 1772300 (freier Volltext).
- Trevor D. Lamb, Shaun P. Collin, Edward N. Pugh Jr.: Evolution of the vertebrate eye: opsins, photoreceptors, retina and eye cup. Nature Reviews, 8, 2007, 960-975
- R. W. Scotland: Deep homology: A view from systematics. BioEssays 32 (5): 438–449, (2010) doi:10.1002/bies.200900175. PMID 20394064
- Fernald, D. Russell: The Evolution of Eyes: Where Do Lenses Come From? Karger Gazette 64: "The Eye in Focus" (2001)
- Dan-Erik Nilsson und Susanne A. Pelger: A pessimistic estimate of the time required for for an eye to evolve. Proceedings of the Royal Society of London. B525, 53-58.1994
- Richard Dawkins: Gipfel des Unwahrscheinlichen. Wunder der Evolution. Rowohlt 1999. Orig.: Climbing Mount Impropable. Viking Penguin Group London 1996
- W. Westheide, R. M. Rieger, G. Rieger, G. Rieger (Hrsg.): Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. Springer Verlag 2. Auflage 2010, Seite 100. ISBN 978-3-8274-2039-8
- Johannes W. Rohen, Elke Lütjen-Drecoll: Funktionelle Histologie. Schattauer, F.K. Verlag 4. Auflage März 2000, S. 476. ISBN 978-3-7945-2044-2
- A. Reichenbach, A. Bringmann (2010). Müller cells in the healthy and diseased retina. New York: Springer. pp 15–20
- Trevor D. Lambs. Das Auge − Organ mit Vergangenheit in: Evolution. Wie sie die Geschichte des Lebens geformt hat. Spektrum der Wissenschaft Spezial 1/2014
- Huxley, Julian (1942/2010): Evolution - The Modern Synthesis. The Definitive Edition, with a Foreword by Massimo Pigliucci and Gerd B. Müller. MIT Press, Cambridge
- Yokoyama, S., and B. F. Radlwimmer. 2001. The molecular genetics and evolution of red and green color vision in vertebrates. Genetics Society of America. 158: 1697-1710
- Timothy H. Goldsmith, Vögel sehen die Welt bunter, in Spektrum der Wissenschaft, Januar 2007, S. 96–103; → Spektrum und (PDF)
- J. K. Bowmaker: Evolution of colour vision in vertebrates. Eye 12 (3b): 541–547. (1998) doi:10.1038/eye.1998.143. PMID 9775215
- K. S. Dulai, M. von Dornum, J. D. Mollon, D. M. Hunt: The evolution of trichromatic color vision by opsin gene duplication in New World and Old World primates. (1999) Genome Research 9 (7): 629–638. doi:10.1101/gr.9.7.629 (zurzeit nicht erreichbar). PMID 10413401
- Diana Widermann, Robert A. Barton, and Russel A. Hill. Evolutionary perspectives on sport and competition. In Roberts, S. C. (2011). Roberts, S. Craig, ed. Applied Evolutionary Psychology. Oxford University Press. doi:10.1093/acprof:oso/9780199586073.001.0001. ISBN 978-0-19-958607-3
- Nathans, J., and D Thomas (1986). "Molecular genetics of human color vision: the genes encoding blue, green and red pigments". Science 232 (4747): 193–203. doi:10.1126/science.2937147. PMID 2937147.
- O.-E. Lund,B. von Barsewisch. Die Macula in der Tierreihe. Erkrankungen der Macula. Deutsche Ophthalmologische Gesellschaft Volume 73, 1975, pp 11–17. Springer
- L. Spinney: How much of the world do we really see? New Scientist 2265.2000
- Cottaris, N.P., de Valois, R.L. Temporal dynamics od chromatic tuning in macaque primary vision cortex. Nature, 395, S. 896–900, 1998
- L. Spinney. Blind to change. New Scientist, 2265. S. 28–32
- D. J. Simons, D. T. Levin: Failure to detect changes to people during real-world interaction. Psychonomic Bulletin and Review 4, S. 644. 1998
- Paul Simoens: Sehorgan, Organum visus. In: Franz-Viktor Salomon, Hans Geyer, Uwe Gille (Hrsg.): Anatomie für die Tiermedizin. 2., überarbeitete und erweiterte Auflage. Enke, Stuttgart u. a. 2008, ISBN 978-3-8304-1075-1, S. 579–612.
- Thomas Geissmann. Vergleichende Primatologie. Springer-Verlag, Berlin u. a. 2002, ISBN 3-540-43645-6.
- L. Roth, A. Kleber, Color vision in nocturnal and diurnal geckos. The Lund Vision group, Universität Lund. 2004
- Kiama, S G.;J. N. Maina;J. Bhattacharjee and K. D. Weyrauch (2001) Functional morphology of the pecten oculi in the nocturnal spotted eagle owl (Bubo bubo africanus), and the diurnal black kite (Milvus migrans) and domestic fowl (Gallus gallus var. domesticus): a comparative study. Journal of Zoology 254: 521-528
- A. Herrel, J.J. Meyers, P. Aerts, K.C. Nishikawa. The Mechanics of prey prehension in chameleons (2000). Journal of Experimental Biology 203: 3255-3263
- J.-P. Ewert: Motion perception shapes the visual world of amphibians, In: F. R. Prete (Hrsg.): Complex Worlds from Simpler Nervous Systems. Cambridge, MA MIT Press 2004, 117-160
- Kenneth T. Brown. A linear area centralis extending across the turtle retina and stabilized to the horizon by non-visual cues. Vision Research 10/1969; 9(9):1053-62
- Halder, Georg, Patrick Callaerts, Walter J. Gehring. (1995) Induction of Ectopic Eyes by Targeted Expression of the eyeless Gene in Drosophila. Science. 267: 1788–1792.
- Michael S. Y. Lee et al.: Modern optics in exceptionally preserved eyes of Early Cambrian arthropods from Australia. In: Nature, Band 474, 2011, S. 631–634, doi:10.1038/nature10097
- R. D. de Voe: Ultraviolet and green receptors in principal eyes of jumping spiders. Journal of Cell Biology, Band 66, Nr. 2, S. 193–207, 1975, doi:10.1085/jpg.66.2.193 (zurzeit nicht erreichbar), PMC 2226199 (freier Volltext)
- Takashi Nagata et al.: Depth perception from image defocus in a jumping spider. Science, Band 335, Nr. 6067, 2012, S. 469–471 doi:10.1126/science.1211667
- Camera eyes in gastropod molluscs, mapoflife.org
- Dan-Erik Nilsson, Eric J. Warrant, Sonke Johnsen, Roger Hanlon and Nadav Shashar: A Unique Advantage for Giant Eyes in Giant Squid. Current Biology 22, 1–6, April 24, 2012. doi:10.1016/j.cub.2012.02.031
- Colossal Squid Exhibition. (Memento vom 20. April 2008 im Internet Archive) Webseite des neuseeländischen Nationalmuseums Te Papa zum untersuchten Koloss-Kalmar.
- Jeanne M. Serb, Douglas J. Eernisse: Charting Evolution's Trajectory: Using Molluscan Eye Diversity to Understand Parallel and Convergent Evolution. In: Evolution: Education and Outreach. 1, 2008, S. 439–447, doi:10.1007/s12052-008-0084-1.
- Tsyr-Huei Chiou, Sonja Kleinlogel, Tom Cronin, Roy Caldwell, Birte Loeffler, Afsheen Siddiqi, Alan Goldizen & Justin Marshall: Circular polarization vision in a stomatopod crustacean. In: Current Biology. 18, Nr. 6, 2008, S. 429–34. doi:10.1016/j.cub.2008.02.066. PMID 18356053.
- C.-C. Chiao, T. W. Cronin, N. J. Marshall: Eye design and color signaling in a stomatopod crustacean Gonodactylus smithii. Brain Behavior and Evolution, 56, S. 107–122. 2000
- C. H. Mazel, T. W. Cronin, R. L. Caldwell & N. J. Marshall: Fluorescent enhancement of signaling in a mantis shrimp. In: Science. 303, Nr. 5654, 2004, S. 51. doi:10.1126/science.1089803. PMID 14615546.
- Bristol University: Mantis shrimps could show us the way to a better DVD, 25 October 2009
- Robert L. Chow, Curtis R. Altmann, Richard A. Lang and Ali Hemmati-Brivanlou. Pax6 induces ectopic eyes in a vertebrate. Development 126, 4213–4222,1999
- D. Uwanogho, M. Rex, E.J. Cartwright, G. Pearl, C. Healy, P.J. Scotting, P.T. Sharpe. Embryonic expression of the chicken Sox2, Sox3 and Sox11 genes suggests an interactive role in neuronal development Mech. Dev., 49 (1995), pp. 23–36
- Reinhard W. Köste,Ronald P. Kühnlein, Joachim Wittbrodt, Ectopic Sox3 activity elicits sensory placode formation. Science direct Volume 95, Issues 1–2, 1 July 2000, Pages 175–187
- Jesper Kronhamn, Erich Frei, Michael Daube, Renjie Jiao, Yandong Shi, Markus Noll, and Åsa Rasmuson-Lestander. Headless flies produced by mutations in the paralogous Pax6 genes eyeless and twin of eyeless. Development 2002 129: 1015-1026
- M. A. Serikaku, J. E. O'Tousa: Sine oculis is a homeobox gene required for Drosophila visual system development. Genetics. 1994 Dec;138(4):1137-50
- Nancy M. Bonini*, Quang T. Bui, Gladys L. Gray-Board and John M. Warrick. The Drosophila eyes absent gene directs ectopic eye formation in a pathway conserved between flies and vertebrates.Development 124, 4819-4826 (1997)
- T. A. Heanue, R. J. Davis, D. H. Rowitch, A. Kispert, A. P. McMahon, G. Mardon, C. J. Tabin Dach1, a vertebrate homologue of Drosophila dachshund, is expressed in the developing eye and ear of both chick and mouse and is regulated independently of Pax and Eya genes. Mech Dev. 2002 Feb;111(1-2):75-87
- Z. Kozmik, Michael Daube, Erich Frei, Barbara Norman, Lidia Kos, Larry J. Dishaw, Markus Noll, Joram Piatigorsky: Role of Pax Genes in Eye Evolution A Cnidarian PaxB Gene Uniting Pax2 and Pax6 Functions. (2003) Developmental Cell 5 (5): 773–785. doi:10.1016/S1534-5807(03)00325-3. PMID 14602077
- Joram Piatigorsky: A Genetic Perspective on Eye Evolution: Gene Sharing, Convergence and Parallelism. Evolution: Education and Outreach 1(4): 403-414 (2008)
- Luitfried Salvini-Plawen: Photoreception and the Polyphyletic Evolution of Photoreceptors (with Special Reference to Mollusca), American Malacological Bulletin 01/2009; doi:10.4003/006.026.0209.
- W. J. Gehring: New perspectives on eye development and the evolution of eyes and photoreceptors. J Hered. 2005 May-Jun;96(3):171-84. Epub 2005 Jan 13
- Multi-eyed jellyfish helps with Darwin's puzzle. Newscientist.com (14. Mai 2005)