Neumünder
Die Neumünder (Neumundtiere, Deuterostomia) stellen einen Überstamm der Zweiseitentiere (Bilateria), von denen die Rückensaitentiere (Chordatiere, Chordata – darunter der Mensch) und die Stachelhäuter (Echinodermata) die hauptsächlichen Taxa sind. Eines der zwei kennzeichnenden gemeinsamen Merkmale der Deuterostomia ist die weitere Entwicklung des Urmundes in der Embryonalentwicklung. Hier wird im Verlauf der Gastrulation der Urmund zum After und der Mund entsteht neu (Deuterostomie). Das zweite Merkmal ist die dorsale (rückenseitige) Lage des Zentralnervensystems (ZNS). Bei den übrigen Zweiseitentieren, den Urmündern (Protostomia), wird hingegen der Urmund zum Mund und der After bricht sekundär durch; das ZNS liegt ventral (bauchseits).[1]
| Neumünder | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
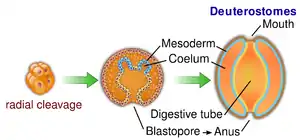
Bei den Neumündern wird der Urmund (Blastoporus) zum After (Anus), die Mundöffnung wird neu gebildet. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Deuterostomia | ||||||||||||
| Grobben, 1908 |
Begriff
Das neunzehnte Jahrhundert sah den Beginn der Entwicklungsbiologie. Frühe embryonale Entwicklungsstadien wurden unter dem Mikroskop genau beobachtet und beschrieben. Als besonders wegweisend und einflussreich[2] erwiesen sich die Leistungen des deutsch-baltischen Naturforschers Karl Ernst von Baer[3] und des deutschen Zoologen Ernst Haeckel.[4] Die Naturwissenschaftler erkannten, dass die Anlage des Verdauungstraktes unter den dreikeimblättrigen Tieren auf zwei unterschiedliche Weisen erfolgt: einmal wird der Urmund zum späteren Mund, der zukünftige Darmtrakt durchwächst den Embryo und der After bricht abschließend durch; ein anderes Mal wird der Urmund zum späteren After, der zukünftige Darmtrakt durchwächst den Embryo und der Mund bricht abschließend durch.
Dieser entwicklungsbiologische Unterschied wurde im Jahr 1875 erstmals vom britischen Biologen Thomas Henry Huxley evolutionsbiologisch gedeutet und gleich zweifach veröffentlicht.[5][6] Huxley sah in der Anlageweise des Verdauungstraktes ein Merkmal, das von sehr fernen Vorfahren entwickelt worden war und seitdem immer weiter durch die sich diversifizierende Nachkommenschaft vererbt wurde. Demzufolge stammten alle heute lebenden dreikeimblättrigen Tiere entweder von einem Vorfahren ab, dessen embryonaler Urmund zum späteren Mund wurde – Urmünder; oder aber sie stammten von einem Vorfahren ab, dessen embryonaler Urmund zum späteren After wurde – Neumünder. Huxley nannte die erste Tiergruppe die Archaeostomata und die zweite Tiergruppe die Deuterostomata.[7][8]
Beide Begriffe wurden schon im nächsten Jahr vom irischen Anatomen Alexander MacAlister in seinem Lehrbuch einer breiteren Öffentlichkeit vorgestellt.[9] Allerdings blieb die Kunde von den Archaeostomata und Deuterostomata auf das englischsprachige Fachpublikum beschränkt. Die Wörter konnten sich nicht im deutschen Sprachgebiet etablieren. Darum prägte der österreichische Zoologe Berthold Hatschek zwölf Jahre später mit dem neuen Wort Zygoneura einen eigenen Begriff für jene Tiergruppe, die Huxley vormals schon als Archaeostomata bezeichnet hatte. Auf der anderen Seite bot Hatschek aber kein Synonym für Huxleys Deuterostomata an.[10]
Diese fachsprachliche Lücke wurde erst im Jahr 1908 vom österreichischen Zoologen Karl Grobben geschlossen. Für seine Abhandlung Die systematische Einteilung des Tierreiches übernahm Grobben anfänglich den Begriff der Zygoneura von Berthold Hatschek, gesellte ihm aber im Laufe des Textes sein eigenes Synonym Protostomia zu. Und den Protostomia stellte er jene Gruppe von dreikeimblättrigen Tieren gegenüber, deren Urmund zum späteren After wird. Diese Gruppe nannte Grobben nun Deuterostomia.[11]
Dreiunddreißig Jahre nach Huxleys Deuterostomata hatte Karl Grobben für den gleichen Begriffsinhalt ein fast gleich lautendes Wort geprägt. Während des zwanzigsten Jahrhunderts setzte sich Grobbens Begriffspaar in der Entwicklungsbiologie und in der Evolutionsbiologie durch. Berthold Hatscheks Zygoneura gerieten genauso in Vergessenheit wie Thomas Henry Huxleys Archaeostomata und eben auch wie seine Deuterostomata. Die biologische Fachsprache benutzt heute normalerweise nur noch die Begriffe Protostomia und Deuterostomia.
„Neumündigkeit“ als ordnendes Merkmal
Nachdem die Neumündigkeit (Deuterostomie) entdeckt worden war, diente sie dazu, die sehr verschieden erscheinenden Tiergruppen der Chordatiere (Chordata), Kiemenlochtiere (Hemichordata) und Stachelhäuter (Echinodermata) zu einer gemeinsamen Abstammungsgemeinschaft zusammenzuführen. Die Abstammungsgemeinschaft erhielt den Namen „Neumünder“ (Neumundtiere, Zweitmünder) oder Deuterostomia (von altgr. δεύτερο- deutero ‚zweit-‘ und στόμα stoma ‚Mund‘).
Jedoch gibt es weitere Tiere, die ebenfalls deuterostome Embryonalentwicklungen zeigen. Neumündigkeit kann bei Pfeilwürmern (Chaetognatha) beobachtet werden, sowie bei einigen Kranzfühlern (Lophophorata) und manchen Saitenwürmern (Nematomorpha) und Gliederfüßern (Arthropoda). Ob die Tiere zu den Deuterostomia zählen sollten, war viele Jahrzehnte umstritten. Mit Hilfe molekularbiologischer Verwandtschaftsforschung (Phylogenomik) wurde in dieser Frage große Klarheit erzielt. Demnach bilden Chordatiere, Kiemenlochtiere und Stachelhäuter tatsächlich eine Abstammungsgemeinschaft. Die restlichen genannten Tiergruppen gehören nicht dazu. Ihre Deuterostomien wurden stattdessen jeweils unabhängig voneinander konvergent evolviert.
Systematik
Die Neumundtiere (Deuterostomia) stellen eine Großgruppe innerhalb des Systems der Tiere. Ihr Schwestertaxon sind die Urmundtiere (Protostomia). Mit ihnen bilden sie die Abstammungsgemeinschaft der Nierentiere (Nephrozoa). Die Nierentiere werden mit den Xenacoelomorpha zusammengefasst zu den Zweiseitentieren (Bilateria).[12]
Äußere Systematik der Deuterostomia (Neumünder) | |
| |
Mehrere Tiergruppen werden wiederum den Neumündern zugeordnet. Fünf von ihnen existieren noch immer, sind also rezent. Taxonomisch wird jede als Stamm oder Unterstamm betrachtet. Die fünf Gruppen können wegen bestimmter Gemeinsamkeiten einem Paar noch umfassenderer Abstammungsgemeinschaften zugeteilt werden. Aufgrund phylogenomischer und vergleichend-entwicklungsbiologischer Erkenntnisse werden die zwei Stämme der Ambulacraria den drei Stämmen der Rückensaitentiere gegenübergestellt.[13]
Großgruppen der rezenten Deuterostomia (Neumünder) | |
|
|
Das System der rezenten Neumünder bringt allerdings nur eine lückenhafte Vorstellung von der Vielfalt der Tiergruppe. Denn es berücksichtigt nicht, dass in vergangenen Perioden der Erdgeschichte weitere Neumünder-Zweige evolviert waren. Jene Zweige sind heute nur noch aus Fossilien bekannt. Sie können dennoch sinnvoll in das vorhandene System eingebaut werden. Allerdings bleiben die Positionen der ausgestorbenen Vetulicolia und Vetulocystida unsicher. Derzeit werden sie als eigener Neumünder-Zweig auf gleicher Stufe neben die Gruppen der Stachelhäuter und der Rückensaitentiere gestellt.[14]
| Systematik der rezenten und fossilen Deuterostomia (Neumünder) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
a: Die Gruppe der spiegelsymmetrischen Stachelhäuter. Echinodermata bilateralia zählten zum Paraphylum der Homalozoa.[16] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
In der dargestellten Systematik werden bestimmte Gruppenbezeichnungen aus unterschiedlichen Gründen nicht mehr verwendet: Acrania (Paraphylum aus Leptocardia, Myllokunmingiida, Pikaiidae und Conodontophora), Ambulacralia (Synonym zu Ambulacraria), Anencephala (Synonym zu Leptocardia), Branchiotremata (Synonym zu Hemichordata), Cephalochordata (Synonym zu Acrania), Cirrostomi (Synonym zu Leptocardia), Chordonia (Synonym zu Chordata), Coelomorpha (Synonym zu Ambulacraria), Craniota (Synonym zu Craniata), Deuterostomata (Synonym zu Deuterostomia), Encephalota (Synonym zu Craniata), Enterocoelomata (Synonym zu Deuterostomia), Euchordata (Synonym zu Notochordata), Myomerozoa (Synonym zu Notochordata), Notochordata (Paraphylum aus Acrania und Craniata), Notoneuralia (Synonym zu Deuterostomia), Pachycardia (Synonym zu Craniata), Pharyngobranchia (Synonym zu Leptocardia), Protochordata (Paraphylum aus Acrania und Tunicata), Urochordata (Synonym zu Tunicata), Vertebrata (Synonym zu Cristozoa oder zu Craniata), Xenambulacraria (Paraphylum aus Xenacoelomorpha und Ambulacraria), Yunnanozoa (umstrittenes Synonym zu Myllokunmingiida). |
Evolution
Die Neumundtiere werden innerhalb der Zweiseitentiere (Bilateria) der Gruppe der Nierentiere (Nephrozoa) zugeordnet.[27] Ihre Schwestergruppe besteht aus den Urmundtieren (Protostomia). Die letzten gemeinsamen Vorfahren von Neumundtieren und Urmundtieren bestanden demzufolge aus spiegelsymmetrisch gebauten Nierentieren. Der Körper dieser Tiere besaß eine Hauptbewegungsrichtung („Vorne“). Entsprechend wurden am vorderen Körperende verstärkt Nervenzellen und Sinneszellen angelegt (Cephalisation).[28] Aus drei Keimblättern entwickelten sich die Körperorgane, zu denen auch Nephridien gehörten.[29]
Phylogenomische Studien mit molekularer Uhr legen nahe, dass diese Nierentiere im oberen Proterozoikum gelebt haben müssten. Genauer gesagt sollten sie während der geologischen Periode namens Cryogenium zur Mitte der sturtischen Eiszeit vor etwa 680 Millionen Jahren existiert haben, bevor sich die Linien der Neumundtiere und der Urmundtiere endgültig trennten. Schon ungefähr 30 Millionen Jahre später spalteten sich die Neumundtiere in die beiden noch heute vorkommenden Gruppen der Ambulacraria und der Rückensaitentiere (Chordata). Die Aufspaltung geschah in der Warmzeit zwischen sturtischer Eiszeit und marinoischer Eiszeit. Auf das Cryogenium folgte das Ediacarium. Im Laufe dieser Periode kam es zu weiteren Aufspaltungen. Sowohl Stachelhäuter (Echinodermata) und Kiemenlochtiere (Hemichordata) als auch Lanzettfischchen (Leptocardia), Cristozoa und Manteltiere (Tunicata) gediehen schon in eigenen Linien, bevor das Kambrium begann.[30] Wahrscheinlich waren die weichhäutigen[31] Tiere bloß wenige Millimeter groß. Die Suche nach ihren Fossilien verlief bisher erfolglos.[32] Erst aus Fossillagerstätten des Unterkambriums wurden Organismen gefördert, die mit großer Sicherheit zu den Neumundtieren gehörten.[33] Auch diese Tiere waren kaum länger als weniger Zentimeter.[34][35] Nur Vertreter des Neumundtier-Zweigs der Vetulicolia erreichte größere Körperlängen, wobei die Art Vetulicola longbaoshanensis mit knapp einem Dezimeter das äußerste Mögliche darstellte.[36]
Älteste fossile Gattungen der Deuterostomia a, b, c | |
| Ambulacraria • Echinodermata • Echinodermata bilateralia | |
|
Ambulacraria • Echinodermata • Echinodermata asymmetrica |
| Ambulacraria • Echinodermata • Echinodermata radiata | |
|
Ambulacraria • Hemichordata • Enteropneusta |
|
Ambulacraria • Hemichordata • Pterobranchia |
|
Chordata • Leptocardia |
|
Chordata • Olfactores • Cristozoa |
|
Chordata • Olfactores • Tunicata |
| Vetulicolia | |
| Vetulocystida | |
| a: Viele der Fossilien stammen von zwei Fossillagerstätten aus dem Kambrium. Die Maotianshan-Schiefer aus Südchina besitzen ein Alter von 520 bis 525 Millionen Jahren. Die Burgess-Schiefer aus Westkanada besitzen ein Alter von etwa 508 Millionen Jahren. b: Wegen ihrer unsicheren taxonomischen Zuordnung wird die Gattung Yunnanozoon[51] (= Cathayamyrus[52][53] = Zhongxiniscus[54], = Haikouella[55][56]) hier nicht berücksichtigt.[57][58] Vielleicht handelte es sich um einen Vorfahren der Rückensaitentiere (Chordata).[59] c: Wegen ihrer unsicheren taxonomischen Zuordnung wird die Gruppe der Cambroernida mit ihren Gattungen Herpetogaster und Phlogites hier nicht berücksichtigt. Vielleicht handelte es sich um Ambulacraria.[60][61] d: Fossilien von Lanzettfischchen (Leptocardia) fehlen. Zwar waren der Klasse schon vier fossile Gattungen zugeordnet worden, alle vier konnten jedoch aus unterschiedlichen Gründen diese Zuordnung nicht behalten.[62] e: Möglicherweise gehörte die Gattung Skeemella ebenfalls zu den Vetulicolia.[63] | |
Körpergestalten und Bewegungstypen
Die millimetergroßen Vertreter der Gattung Saccorhytus könnten die ältesten fossil bekannten Neumundtiere darstellen. Die säckchenartigen Organismen wurden taxonomisch in die Nähe der Vetulicolia und Vetulocystida gestellt[14] und in den 535 Millionen Jahre alten Kuanchuanpu-Schiefern in Südchina gefunden.[61] Vermutlich zeigten die winzigen Tiere einen sehr vereinfachten Bauplan. Denn im Gegensatz zu Saccorhytus besaßen die letzten gemeinsamen Vorfahren aller Neumundtiere wahrscheinlich wurmförmige Gestalt.[32] Es ist nicht geklärt, ob die Tiere auf dem Meeresboden (oder ähnlichem) festsaßen (benthisch-sessiler Bewegungstyp), über den Meeresboden krochen oder sich durch ihn bohrten (benthisch-vagiler Bewegungstyp oder subbenthisch-vagiler Bewegungstyp) oder sich sogar freischwimmend bewegten (pelagisch-vagiler Bewegungstyp),[64][65] obwohl letzteres aktuell als eher unwahrscheinlich gilt.[32]
Die Ambulacraria behielten mehrheitlich die benthische Lebensweise bei. Die ersten Stachelhäuter (Echinodermata) waren noch bilateralsymmetrisch gebaut[66][67] und bewegten sich kriechend oder springend[68] über den Meeresboden.[69] Doch schon im Unterkambrium verloren viele ihre Spiegelsymmetrie zu Gunsten unsymmetrisch oder radiärsymmetrisch gebauter Körper.[70][71][72] Der Tausch der Bilateralsymmetrie mit der Radiärsymmetrie ging einher mit dem Tausch des benthisch-vagilen Bewegungstyps mit dem benthisch-sessilen Bewegungstyp. Dauerhaft festsitzende Tiere benötigen keinen Körperbau mehr, der auf eine Hauptbewegungsrichtung ausgelegt ist.[73][18][74] Von solchen sessilen und pentaradiären Stachelhäutern stammen alle rezenten Formen ab,[75] möglicherweise gingen sie aus der fossilen Gattung Camptostroma hervor.[73] Nur die Larven behielten einen bilaterialsymmetrischen Bau.[76] Außer den noch immer sessilen Seelilien kehrten die übrigen Stachelhäuter-Gruppen später zum benthisch-vagilen Bewegungstyp zurück. Das gilt sowohl für die nahe verwandten Haarsterne[77] als auch für die Gesamtheit der Eleutherozoa, also für Seewalzen (Holothuroidea), Seeigel (Echinoidea), Seesterne (Asteroidea) und Schlangensterne (Ophiuroidea). Fast die Hälfte aller heutigen Seeigelarten („Irregularia“) zeigen Ansätze einer sekundär bilateralsymmetrischen Körpergestalt, die bei den Seewalzen wieder vollständig ausgeprägt wurde.[78]
Die anderen Ambulacraria, die Kiemenlochtiere (Hemichordata), legten sich ebenfalls auf benthische Bewegunstypen fest. Eichelwürmer (Enteropneusta) bohren sich durch die oberen Meeresböden,[79] Flügelkiemer (Pterobranchia) bleiben die meiste Zeit in festsitzenden Röhren, die sie aber manchmal kriechend verlassen. Tiere aus der Flügelkiemer-Familie der Cephalodiscidae bewegen sich auf dem Meeresboden umher, ohne jemals Wohnröhren anzulegen.[80]
Die Rückensaitentiere (Chordata) gingen andererseits zu einer freischwimmenden Lebensweise über. Sie entwickelten langgestreckte und seitlich abgeflachte Körper, die mit einer Chorda dorsalis stabilisiert wurden.[81] Die heutigen Lanzettfischchen (Leptocardia) bewegen sich aber nur selten im freien Wasser. Stattdessen vergraben sie sich mit dem Schwanzende voran in grobem Sand oder legen sich bei festerem Meeresgrund flach auf die Seite.[82] Auch die ersten Olfactores führten wahrscheinlich ein pelagisches Leben.[83] Davon wichen die frühen Cristozoa nicht ab, wie an Fossilien der Myllokunmingiida, Pikaiidae und Conodontophora nachvollzogen werden kann. Die übrigen Olfactores, die Manteltiere (Tunicata), wechselten schon im Unterkambrium zum benthisch-sessilen Bewegungstyp,[47] behielten aber pelagische Larvenstadien.[84] Die adulten Tiere verloren ihren bilateralsymmetrischen Körperbau.[39] Später kehrten die Manteltier-Gruppen der Salpen (Thaliacea) und der Appendikularien (Copelata) auch für das erwachsene Leben in das freie Wasser zurück.[85] Dazu verblieben die Appendikularien fortan auch für das Erwachsenenalter in ihrer bilateralsymmetrischen larvalen Gestalt.[86]
Die Körpergestalten der ausgestorbenen Vetulocystida und Vetulicolia können nur anhand von Fossilien aus dem Kambrium nachvollzogen werden. Vetulocystida waren bilateralsymmetrisch gebaut.[87] Ihre Körper waren zweigeteilt mit abgeplatteten, breiten Vorderkörpern und Schwänzen, die mittig hinten an den Vorderkörpern ansetzten und ungefähr ein Drittel von deren Breite besaßen.[88] Vermutlich ruhten Vetulocystida die meiste Zeit an einer Stelle auf dem Meeresboden. Sie fanden Halt, indem sie ihren Schwanz im Untergrund vergruben, so dass nur noch der Vorderkörper herausschaute. Gelegentlich wechselten sie ihren Standort, indem sie Vortrieb mit Hilfe ihrer Schwänze erzeugten, die sie seitlich hin und her schwenkten.[89]
Der Körperbau der Vetulicolia glich in gewisser Weise jenem der Vetulocystida. Auch sie besaßen bilateralsymmetrische Gestalten mit breiten Vorderkörpern und Schwänzen.[90] Allerdings waren die Vorderkörper nicht abgeplattet, sondern seitlich abgeflacht.[91] Weiterhin setzten die Schwänze nicht mittig an, sondern in der Nähe der hinteren oberen Körperenden (dorsal-posterior).[92][93][94] Vetulicolia lagerten wahrscheinlich die meiste Zeit am Meeresboden und konnten bei Gefahr einfach davonschwimmen.[95] Zwei Gattungen wichen von dieser Lebensweise ab. Banffia ging zu einem grabenden Dasein über.[95] Demhingegen entwickelte sich Vetulicola zu reinen Schwimmern[96] mit sehr stromlinienförmigem Körperbau.[97]
Weblinks
Einzelnachweise
- Hynek Burda: Allgemeine Zoologie. Verlag Eugen Ulmer, Stuttgart, 2005, ISBN 3-8001-2838-1, S. 55.
- Thomas Henry Huxley: On the classification of the animal kingdom. In: The Journal of the Linnean Society. Zoology. Band 12, 1875, doi:10.1111/j.1096-3642.1875.tb02582.x, S. 200, 207.
- Karl Ernst von Baer: Über Entwicklungsgeschichte der Thiere • Erster Theil. Verlag Gebrüder Bornträger, Königsberg, 1828.
- Ernst Haeckel: Die Biologie der Kalkschwämme. Georg Reimer Verlag, Berlin, 1872, S. 328–339 (Digitalisat).
- Thomas Henry Huxley: On the classification of the animal kingdom. In: The Journal of the Linnean Society. Zoology. Band 12, 1875, doi:10.1111/j.1096-3642.1875.tb02582.x, S. 199–226.
- Thomas Henry Huxley: On the classification of the animal kingdom. In: The American Naturalist. Band 09, 1875, doi:10.1086/271442, S. 65–70.
- Thomas Henry Huxley: On the classification of the animal kingdom. In: The Journal of the Linnean Society. Zoology. Band 12, 1875, doi:10.1111/j.1096-3642.1875.tb02582.x, S. 207.
- Thomas Henry Huxley: On the classification of the animal kingdom. In: The American Naturalist. Band 09, 1875, doi:10.1086/271442, S. 67.
- Alexander MacAlister: An Introduction to Animal Morphology and Systematic Zoology • Part I. Publishers Longmans, Green and Co., London, 1876. S. 48 (Digitalisat).
- Berthold Hatschek: Lehrbuch der Zoologie • Erste Lieferung. Gustav Fischer Verlag, Jena, 1888, S. 41.
- Karl Grobben: Die systematische Einteilung des Tierreiches. In: Verhandlungen der Zoologisch-Botanischen Gesellschaft in Wien. Band 58, 1908, S. 496–497 (zobodat.at [PDF]).
- Johanna Taylor Cannon, Bruno Cossermelli Vellutini, Julian Smith, Fredrik Ronquist, Ulf Jondelius, Andreas Hejnol: Xenacoelomorpha is the sister group to Nephrozoa. In: Nature. Band 530, 2016, doi:10.1038/nature16520, S. 89–93.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hg.): Spezielle Zoologie • Teil 1. Springer-Verlag, Berlin/Heidelberg, 2013, ISBN 978-3-642-34695-8, S. 716.
- Jian Han, Simon Conway Morris, Qiang Ou, Degan Shu, Hai Huang: Meiofaunal deuterostomes from the basal Cambrian of Shaanxi (China). In: Nature. Band 542, 2017, doi:10.1038/nature21072, S. 230.
- Systematik nach (1a) Diego C. García-Bellido, Michael S. Y. Lee, Gregory D. Edgecombe, James B. Jago, James G. Gehling, John R. Paterson: A new vetulicolian from Australia and its bearing on the chordate affinities of an enigmatic Cambrian group. In: BMC Evolutionary Biology. Band 14, 2014, doi:10.1186/s12862-014-0214-z, S. 8, aktualisiert mit (1b) Jian Han, Simon Conway Morris, Qiang Ou, Degan Shu, Hai Huang: Meiofaunal deuterostomes from the basal Cambrian of Shaanxi (China). In: Nature. Band 542, 2017, doi:10.1038/nature21072, S. 230. (2) Philip C. J. Donoghue, Joseph N. Keating: Early vertebrate evolution. In: Palaeontology. Band 57, 2014, doi:10.1111/pala.12125, S. 880. Systematik der Echinodermata vereinfacht nach (3) Andrew B. Smith, Samuel Zamora: Cambrian spiral-plated echinoderms from Gondwana reveal the earliest pentaradial body plan. In: Proceedings of the Royal Society B. Band 280, 2013, doi:10.1098/rspb.2013.1197, S. 5. Systematik der Hemichordata nach (4) Johanna T. Cannon, Kevin M. Kocot, Damien S. Waits, David A. Weese, Billie J. Swalla, Scott R. Santos, Kenneth M. Halanych: Phylogenomic Resolution of the Hemichordate and Echinoderm Clade. In: Current Biology. Band 24, 2014, doi:10.1016/j.cub.2014.10.016, S. 2829. Systematik der Vetulicolia nach (5) Richard J. Aldridge, Hou Xian-Guang, David J. Siveter, Derek J. Siveter and Sarah E. Gabbot: The Systematics and Phylogenetic Relationships of Vetulicolians. In: Palaeontology. Band 50, 2007, doi:10.1111/j.1475-4983.2006.00606.x, S. 133, 147.
- Georges Ubaghs: Early Paleozoic Echinoderms. In: Annual Review of Earth and Planetary Sciences. Band 3, 1975, doi:10.1146/annurev.ea.03.050175.000455, S. 95.
- Georges Ubaghs: Early Paleozoic Echinoderms. In: Annual Review of Earth and Planetary Sciences. Band 3, 1975, doi:10.1146/annurev.ea.03.050175.000455, S. 96.
- Andrew B. Smith, Samuel Zamora: Cambrian spiral-plated echinoderms from Gondwana reveal the earliest pentaradial body plan. In: Proceedings of the Royal Society B. Band 280, 2013, doi:10.1098/rspb.2013.1197, S. 5.
- Andrew B. Smith, Samuel Zamora: Cambrian spiral-plated echinoderms from Gondwana reveal the earliest pentaradial body plan. In: Proceedings of the Royal Society B. Band 280, 2013, doi:10.1098/rspb.2013.1197, S. 1.
- Vergleiche (1) Georges Ubaghs: General Characters of Echinodermata. In: Raymond C. Moore (Hg.): Treatise of Invertebrate Paleontology – Part S • Echinodermata 1. University of Kansas and Geological Society of America, Lawrence (Kansas), 1989, ISBN 0-8137-3020-1, S. 54. mit (2) Arno Hermann Müller: Lehrbuch der Paläozoologie – Band II, Teil 3. Gustav Fischer Verlag, Jena, 1989, ISBN 3-334-00165-2, S. 314.
- Greg W. Rouse, Lars S. Jermiin, Nerida G. Wilson, Igor Eeckhaut, Deborah Lanterbecq, Tatsuo Oji, Craig M. Young, Teena Browning, Paula Cisternas, Lauren E. Helgen, Michelle Stuckey, Charles G. Messing: Fixed, free, and fixed: The fickle phylogeny of extant Crinoidea (Echinodermata) and their Permian–Triassic origin. In: Molecular Phylogenetics and Evolution. Band 66, 2013, doi:10.1016/j.ympev.2012.09.018, S. 161, 171, 178.
- Maximilian J. Telford, Christopher J. Lowe, Christopher B. Cameron, Olga Ortega-Martinez, Jochanan Aronowicz, Paola Oliveri, Richard R. Copley: Phylogenomic analysis of echinoderm class relationships supports Asterozoa. In: Proceedings of the Royal Society B. Band 281, 2014, doi:10.1098/rspb.2014.0479, S. 6.
- Jun-Yuan Chen: Early crest animals and the insight they provide into the evolutionary origin of craniates. In: Genesis. Band 46, 2008, doi:10.1002/dvg.20445, S. 623.
- Simon Conway Morris, Jean-Bernard Caron: Pikaia gracilens Walcott, a stem-group chordate from the Middle Cambrian of British Columbia. In: Biological Reviews. Band 87, 2012, doi:10.1111/j.1469-185X.2012.00220.x, S. 480.
- Philip C. J. Donoghue, Joseph N. Keating: Early vertebrate evolution. In: Palaeontology. Band 57, 2014, doi:10.1111/pala.12125, S. 883.
- Michael J. Benton: Paläontologie der Wirbeltiere. Verlag Dr. Friedrich Pfeil, München 2007, ISBN 978-3-89937-072-0, S. 53.
- Johanna Taylor Cannon, Bruno Cossermelli Vellutini, Julian Smith, Fredrik Ronquist, Ulf Jondelius, Andreas Hejnol: Xenacoelomorpha is the sister group to Nephrozoa. In: Nature. Band 530, 2016, doi:10.1038/nature16520, S. 89.
- Andrew B. Smith: Cambrian problematica and the diversification of deuterostomes. In: BMC Biology. Band 10, 2012, doi:10.1186/1741-7007-10-79, Artikel Nr. 79, S. 3.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 80, 82.
- Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, doi:10.1038/s41598-017-03791-w, S. 4.
- Rachel Wood, Andrey Yu Ivantsov, Andrey Yu Zhuravlev: First macrobiota biomineralization was environmentally triggered. In: Proceedings of the Royal Society B. Band 284, 2017, doi:10.1098/rspb.2017.0059, S. 1.
- Jian Han, Simon Conway Morris, Qiang Ou, Degan Shu, Hai Huang: Meiofaunal deuterostomes from the basal Cambrian of Shaanxi (China). In: Nature. Band 542, 2017, doi:10.1038/nature21072, S. 231.
- John A. Cunningham, Alexander G. Liu, Stefan Bengtson and Philip C. J. Donoghue: The origin of animals: Can molecular clocks and the fossil record be reconciled? In: Bioessays. Band 39, 2016, doi:10.1002/bies.201600120, S. 1–12.
- Michael J. Benton: Paläontologie der Wirbeltiere. Verlag Dr. Friedrich Pfeil, München 2007, ISBN 978-3-89937-072-0, S. 19, 21.
- Samuel Zamora, Imran A. Rahman, Andrew B. Smith: Plated Cambrian Bilaterians Reveal the Earliest Stages of Echinoderm Evolution. In: PLoS ONE. Band 7, 2012, doi:10.1371/journal.pone.0038296, e38296, S. 2.
- JinShu Li, JianNi Liu, Qiang Ou: New observations on Vetulicola longbaoshanensis from the Lower Cambrian Guanshan Biota (Series 2, Stage 4), South China. In: Science China Earth Sciences. Band 60, 2017, doi:10.1007/s11430-017-9088-y, S. 1798.
- Samuel Zamora, Imran A. Rahman, Andrew B. Smith: Plated Cambrian Bilaterians Reveal the Earliest Stages of Echinoderm Evolution. In: PLoS ONE. Band 7, 2012, doi:10.1371/journal.pone.0038296, e38296, S. 4.
- Domínguez Alonso: Sistemática, anatomía, estructura y función de Ctenocystoidea (Echinodermata, Carpoidea) del Paleozoico Inferior. Universidad Complutense de Madrid, Madrid 1999, S. 207–215 (PDF-Datei).
- Samuel Zamora, Imran A. Rahman, Andrew B. Smith: Plated Cambrian Bilaterians Reveal the Earliest Stages of Echinoderm Evolution. In: PLoS ONE. Band 7, 2012, doi:10.1371/journal.pone.0038296, e38296, S. 10.
- Jean-Bernard Caron, Simon Conway Morris, Christopher B. Cameron: Tubicolous enteropneusts from the Cambrian period. In: Nature. Band 495, 2013, doi:10.1038/nature12017, S. 503.
- Shixue Hu, Bernd-D. Erdtmann, Michael Steiner, Yuandong Zhang, Fangchen Zhao, Zhiliang Zhang, Jian Han: Malongitubus: a possible pterobranch hemichordate from the early Cambrian of South China. In: Journal of Paleontology. Band 92, 2017, doi:10.1017/jpa.2017.134, S. 26.
- Degan Shu: A paleontological perspective of vertebrate origin. In: Chinese Science Bulletin. Band 48, 2003, doi:10.1007/BF03187041, S. 725.
- Hou Xian-gang, Richard J. Aldridge, David J. Siveter, Derek J. Siveter, and Feng Xiang-hong: New evidence on the anatomy and phylogeny of the earliest vertebrates. I. Proceedings of the Royal Society B: Biological Sciences. Band 269, 2002, doi:10.1098/rspb.2002.2104, S. 1865.
- Simon Conway Morris, Jean-Bernard Caron: A primitive fish from the Cambrian of North America. In: Nature. Band 512, 2014, doi:10.1038/nature13414, S. 419.
- Degan Shu: A paleontological perspective of vertebrate origin. In: Chinese Science Bulletin. Band 48, 2003, doi:10.1007/BF03187041, S. 727.
- Vladimir V. Missarzhevsky: Conodont-shaped organisms from the Precambrian-Cambrian boundary strata of the Siberian Platform and Kazakhstan. In: I.T. Zhuravleva (Hrsg.): Palaeontological and Biostratigraphic Problems in the Lower Cambrian of Siberia and the Far East. Nauka, Novosibirsk 1973, S. 53.
- Jun-Yuan Chen, Di-Ying Huang, Qing-Qing Peng, Hui-Mei Chi, Xiu-Qiang Wang, Man Feng: The first tunicate from the Early Cambrian of South China. In: Proceedings of the National Academy of Sciences. Band 100, 2003, doi:10.1073/pnas.1431177100, S. 8314.
- Systematik nach (1a) Diego C. García-Bellido, Michael S. Y. Lee, Gregory D. Edgecombe, James B. Jago, James G. Gehling, John R. Paterson: A new vetulicolian from Australia and its bearing on the chordate affinities of an enigmatic Cambrian group. In: BMC Evolutionary Biology. Band 14, 2014, doi:10.1186/s12862-014-0214-z, S. 2.
- D.-G. Shu, S. Conway Morris, J. Han, Z.-F. Zhang, J.-N. Liu: Ancestral echinoderms from the Chengjiang deposits of China. In: Nature. Band 430, 2004, doi:10.1038/nature02648, S. 422.
- Simon Conway Morris, Susan L. Halgedahl, Paul Selden, and Richard D. Jarrard: Rare primitive deuterostomes from the Cambrian (Series 3) of Utah. In: Journal of Paleontology. Band 89, 2015, doi:10.1017/jpa.2015.40, S. 634.
- Jun-Yuan Chen: Early crest animals and the insight they provide into the evolutionary origin of craniates. In: Genesis. Band 46, 2008, doi:10.1002/dvg.20445, S. 625.
- Jun-Yuan Chen: Early crest animals and the insight they provide into the evolutionary origin of craniates. In: Genesis. Band 46, 2008, doi:10.1002/dvg.20445, S. 625, 627.
- Pei-Yun Cong, Xian-Guang Hou, Richard J. Aldridge, Mark A. Purnell, Yi-Zhen Li: New data on the palaeobiology of the enigmatic yunnanozoans from the Chengjiang Biota, Lower Cambrian, China. In: Palaeontology. Band 58, 2014, doi:10.1111/pala.12117, S. 67.
- Degan Shu: A paleontological perspective of vertebrate origin. In: Chinese Science Bulletin. Band 48, 2003, doi:10.1007/BF03187041, S. 733.
- Pei-Yun Cong, Xian-Guang Hou, Richard J. Aldridge, Mark A. Purnell, Yi-Zhen Li: New data on the palaeobiology of the enigmatic yunnanozoans from the Chengjiang Biota, Lower Cambrian, China. In: Palaeontology. Band 58, 2014, doi:10.1111/pala.12117, S. 46.
- Jun-Yuan Chen: Early crest animals and the insight they provide into the evolutionary origin of craniates. In: Genesis. Band 46, 2008, doi:10.1002/dvg.20445, S. 623–624.
- Degan Shu, Simon Conway Morris, Z. F. Zhang, J. N. Liu, Jian Han, Ling Chen, X. L. Zhang, K. Yasui, Yong Li: A New Species of Yunnanozoan with Implications for Deuterostome Evolution. In: Science. Band 299, 2003, doi:10.1126/science.1079846, S. 1380.
- Pei-Yun Cong, Xian-Guang Hou, Richard J. Aldridge, Mark A. Purnell, Yi-Zhen Li: New data on the palaeobiology of the enigmatic yunnanozoans from the Chengjiang Biota, Lower Cambrian, China. In: Palaeontology. Band 58, 2014, doi:10.1111/pala.12117, S. 65–66, 68.
- Michael J. Benton: Paläontologie der Wirbeltiere. Verlag Dr. Friedrich Pfeil, München 2007, ISBN 978-3-89937-072-0, S. 21–22.
- Jean-Bernard Caron, Simon Conway Morris, Degan Shu: Tentaculate Fossils from the Cambrian of Canada (British Columbia) and China (Yunnan) Interpreted as Primitive Deuterostomes. In: PLoS ONE. Band 5, 2010, doi:10.1371/journal.pone.0009586, e9586, S. 11.
- Jian Han, Simon Conway Morris, Qiang Ou, Degan Shu, Hai Huang: Meiofaunal deuterostomes from the basal Cambrian of Shaanxi (China). In: Nature. Band 542, 2017, doi:10.1038/nature21072, S. 228.
- Jun-Yuan Chen: Early crest animals and the insight they provide into the evolutionary origin of craniates. In: Genesis. Band 46, 2008, doi:10.1002/dvg.20445, S. 625, 627–628.
- Derek E. G. Briggs, Bruce S. Lieberman, Susan L. Halgedahl, Richard D. Jarrard: A new metazoan from the Middle Cambrian of Utah and the nature of the Vetulicolia. In: Palaeontology. Band 48, 2005, doi:10.1111/j.1475-4983.2005.00489.x, S. 681.
- Dietrich Starck: Vergleichende Anatomie der Wirbeltiere Band 2. Springer-Verlag, Berlin/Heidelberg 1979, ISBN 3-540-09156-4, S. 36.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-642-34695-8, S. 717.
- Samuel Zamora, Imran A. Rahman, Andrew B. Smith: Plated Cambrian Bilaterians Reveal the Earliest Stages of Echinoderm Evolution. In: PLoS ONE. Band 7, 2012, doi:10.1371/journal.pone.0038296, e38296, S. 1.
- Junfeng Guo, Yong Li, Huiping Han, Qiang Ou, Jianren Zhou, Yajuan Zheng: New Macroscopic Problematic Fossil from the Early Cambrian Yanjiahe Biota, Yichang, Hubei, China. In: Acta Geologica Sinica. Band 86, 2012, doi:10.1111/j.1755-6724.2012.00706.x, S. 795.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 461.
- Arno Hermann Müller: Lehrbuch der Paläozoologie – Band II, Teil 3. Gustav Fischer Verlag, Jena, 1989, ISBN 3-334-00165-2, S. 296, 299.
- Richard P. S. Jefferies, Nigel A. Brown and Paul E. J. Daley: The Early Phylogeny of Chordates and Echinoderms and the Origin of Chordate Left-Right Asymmetry and Bilateral Symmetry. In: Acta Zoologica. Band 77, 1996, doi:10.1111/j.1463-6395.1996.tb01256.x, S. 106, Abb. a.
- Arno Hermann Müller: Lehrbuch der Paläozoologie – Band II, Teil 3. Gustav Fischer Verlag, Jena, 1989, ISBN 3-334-00165-2, S. 296.
- Andrew B. Smith: Deuterostomes in a twist: the origins of a radical new body plan. In: Evolution & Development. Band 10, 2008, doi:10.1111/j.1525-142X.2008.00260.x, S. 493.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-642-34695-8, S. 746.
- Arno Hermann Müller: Lehrbuch der Paläozoologie – Band II, Teil 3. Gustav Fischer Verlag, Jena, 1989, ISBN 3-334-00165-2, S. 314.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-642-34695-8, S. 745.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 452.
- Greg W. Rouse, Lars S. Jermiin, Nerida G. Wilson, Igor Eeckhaut, Deborah Lanterbecq, Tatsuo Oji, Craig M. Young, Teena Browning, Paula Cisternas, Lauren E. Helgen, Michelle Stuckey, Charles G. Messing: Fixed, free, and fixed: The fickle phylogeny of extant Crinoidea (Echinodermata) and their Permian–Triassic origin. In: Molecular Phylogenetics and Evolution. Band 66, 2013, doi:10.1016/j.ympev.2012.09.018, S. 170.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-642-34695-8, S. 729.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 445.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 442–443.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 489.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 507.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-642-34695-8, S. 780.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/Berlin, 2004, ISBN 3-8274-1112-2, S. 493.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hg.): Spezielle Zoologie • Teil 1. Springer-Verlag, Berlin/Heidelberg, 2013, ISBN 978-3-642-34695-8, S. 781.
- Alfred Goldschmid: Deuterostomia. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-642-34695-8, S. 786.
- D.-G. Shu, S. Conway Morris, J. Han, Z.-F. Zhang, J.-N. Liu: Ancestral echinoderms from the Chengjiang deposits of China. In: Nature. Band 430, 2004, doi:10.1038/nature02648, S. 422–423.
- D.-G. Shu, S. Conway Morris, J. Han, Z.-F. Zhang, J.-N. Liu: Ancestral echinoderms from the Chengjiang deposits of China. In: Nature. Band 430, 2004, doi:10.1038/nature02648, S. 423.
- D.-G. Shu, S. Conway Morris, J. Han, Z.-F. Zhang, J.-N. Liu: Ancestral echinoderms from the Chengjiang deposits of China. In: Nature. Band 430, 2004, doi:10.1038/nature02648, S. 426.
- Qiang Ou, Simon Conway Morris, Jian Han, Zhifei Zhang, Jianni Liu, Ailin Chen, Xingliang Zhang, Degan Shu: Evidence for gill slits and a pharynx in Cambrian vetulicolians: implications for the early evolution of deuterostomes. In: BMC Biology. Band 10, 2012, doi:10.1186/1741-7007-10-81, Artikel Nr. 81, S. 2.
- Qiang Ou, Simon Conway Morris, Jian Han, Zhifei Zhang, Jianni Liu, Ailin Chen, Xingliang Zhang, Degan Shu: Evidence for gill slits and a pharynx in Cambrian vetulicolians: implications for the early evolution of deuterostomes. In: BMC Biology. Band 10, 2012, doi:10.1186/1741-7007-10-81, Artikel Nr. 81, S. 5, 10.
- Qiang Ou, Simon Conway Morris, Jian Han, Zhifei Zhang, Jianni Liu, Ailin Chen, Xingliang Zhang, Degan Shu: Evidence for gill slits and a pharynx in Cambrian vetulicolians: implications for the early evolution of deuterostomes. In: BMC Biology. Band 10, 2012, doi:10.1186/1741-7007-10-81, Artikel Nr. 81, S. 10.
- JinShu Li, JianNi Liu, Qiang Ou: New observations on Vetulicola longbaoshanensis from the Lower Cambrian Guanshan Biota (Series 2, Stage 4), South China. In: Science China Earth Sciences. Band 60, 2017, doi:10.1007/s11430-017-9088-y, S. 1795, 1799.
- Systematik nach (1a) Diego C. García-Bellido, Michael S. Y. Lee, Gregory D. Edgecombe, James B. Jago, James G. Gehling, John R. Paterson: A new vetulicolian from Australia and its bearing on the chordate affinities of an enigmatic Cambrian group. In: BMC Evolutionary Biology. Band 14, 2014, doi:10.1186/s12862-014-0214-z, S. 3.
- Simon Conway Morris, Susan L. Halgedahl, Paul Selden, and Richard D. Jarrard: Rare primitive deuterostomes from the Cambrian (Series 3) of Utah. In: Journal of Paleontology. Band 89, 2015, doi:10.1017/jpa.2015.40, S. 635.
- JinShu Li, JianNi Liu, Qiang Ou: New observations on Vetulicola longbaoshanensis from the Lower Cambrian Guanshan Biota (Series 2, Stage 4), South China. In: Science China Earth Sciences. Band 60, 2017, doi:10.1007/s11430-017-9088-y, S. 1801.
- Qiang Ou, Simon Conway Morris, Jian Han, Zhifei Zhang, Jianni Liu, Ailin Chen, Xingliang Zhang, Degan Shu: Evidence for gill slits and a pharynx in Cambrian vetulicolians: implications for the early evolution of deuterostomes. In: BMC Biology. Band 10, 2012, doi:10.1186/1741-7007-10-81, Artikel Nr. 81, S. 7–8.