Mandelonitril
Mandelonitril ist eine chemische Verbindung aus der Gruppe der substituierten Nitrile und Alkohole, es ist das Nitril der Mandelsäure. Sie kommt zwei stereoisomeren Formen vor.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Mandelonitrile_Structural_formula_V1.svg.png.webp) | ||||||||||||||||
| Vereinfachte Strukturformel ohne eindeutige Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Mandelonitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H7NO | |||||||||||||||
| Kurzbeschreibung |
gelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 133,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,530 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Stereoisomerie
Die Tabelle zeigt beide Stereoisomere des Mandelonitrils. Sie unterscheiden sich in der Position der Hydroxygruppe (OH), die in dieser Darstellung entweder hinter der Zeichenebene liegt [(R)-Form] oder aus der Zeichenebene herausragt (S)-Form:
| Isomere von Mandelonitril | ||
| Name | (S)-Mandelonitril | (R)-Mandelonitril |
| Andere Namen | (−)-Mandelonitril | (+)-Mandelonitril |
| Strukturformel | -Mandelonitrile_Structural_formula_V1.svg.png.webp) |
-Mandelonitrile_Structural_formula_V1.svg.png.webp) |
| CAS-Nummer | 28549-12-4 | 10020-96-9 |
| 532-28-5 (Racemat) | ||
| EG-Nummer | 686-184-9 | 624-802-0 |
| 208-532-7 (Racemat) | ||
| ECHA-Infocard | 100.211.895 | 100.153.359 |
| 100.007.758 (Racemat) | ||
| PubChem | 439767 | 9548674 |
| 10758 (Racemat) | ||
| DrugBank | DB04737 | – |
| – (Racemat) | ||
| Wikidata | Q27095474 | Q27109028 |
| Q3844407 (Racemat) | ||
Vorkommen
Mandelonitril kommt natürlich in kleinen Mengen in den Samenkernen einiger Früchte vor. Mandelsäurenitril ist hier das Aglycon der cyanogenen Glycoside Prunasin und Amygdalin.[3] Prunasin-beta-glucosidase ist ein Enzym, das Prunasin und Wasser zu D-Glucose und Mandelonitril umwandelt.[5]
Gewinnung und Darstellung
Mandelonitril kann durch Reaktion von Benzaldehyd mit Natriumhydrogensulfit und anschließende Umsetzung des Reaktionsproduktes mit einer wässrigen Lösung von Natriumcyanid oder Kaliumcyanid[6] zum Racemat gewonnen werden.[3][7]
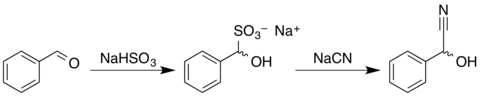
Eigenschaften
Mandelonitril ist eine brennbare, schwer entzündbare, gelbe Flüssigkeit, die sehr schwer löslich in Wasser ist. Sie zersetzt sich bei Erhitzung über 170 °C.[1]
Verwendung
Das natürlich vorkommende (R)-(+)-Enantiomer wird als Zwischenprodukt bei der Synthese von optisch aktiven Verbindungen wie α-Hydroxycarbonsäuren, α-Hydroxyaldehyden, α-Hydroxyketonen und 2-Aminoalkoholen verwendet.[3]
Sicherheitshinweise
Die Dämpfe von Mandelonitril können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 86 °C) bilden.[1] Mandelsäurenitril verursacht schwere Augenschäden und wirkt giftig bei Hautkontakt und beim Einatmen.[3]
Einzelnachweise
- Eintrag zu Mandelonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Mandelonitrile, technical grade bei Sigma-Aldrich, abgerufen am 25. Juni 2017 (PDF).
- Eintrag zu Mandelsäurenitril. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juni 2017.
- Datenblatt DL-Mandelsäurenitril (PDF) bei Merck, abgerufen am 25. Juni 2017.
- Emil Lehnartz: Einführung in die Chemische Physiologie. Springer-Verlag, 2013, ISBN 978-3-662-36817-6, S. 267 (eingeschränkte Vorschau in der Google-Buchsuche).
- Franz v. Bruchhausen, Gerd Dannhardt, Siegfried Ebel, August W. Frahm, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis Band 8: Stoffe E-O. Springer-Verlag, 2013, ISBN 978-3-642-57994-3, S. 808 (eingeschränkte Vorschau in der Google-Buchsuche).
- B. B. Corson, Ruth A. Dodge, S. A. Harris, J. S. Yeaw: Mandelic Acid In: Organic Syntheses. 6, 1926, S. 58, doi:10.15227/orgsyn.006.0058; Coll. Vol. 1, 1941, S. 336 (PDF).

