CBS-Reduktion
Die CBS-Reduktion oder Corey-Bakshi-Shibata-Reduktion ist eine 1987 von den Chemikern Elias James Corey, Raman Bakshi und Saizo Shibata entwickelte enantioselektive Reduktion von Ketonen zu den homochiralen sekundären Alkoholen.[1] Der CBS-Katalysator selbst ist ein chirales Auxiliar, welches chemisch von der Aminosäure Prolin abgeleitet ist. Sie wird nach dem japanischen Chemiker Shinichi Itsuno auch als Corey-Itsuno-Reaktion oder -Verfahren bezeichnet. Dieser beschrieb 1981 erstmals die enantioselektive Reduktion von Ketonen durch Borhydrid und chirale Aminoalkohole.[2][3]
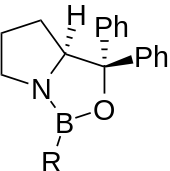
Der CBS-Katalysator wird bei dieser Reaktion als chiraler Katalysator bei der Reduktion von prochiralen Ketonen zu sekundären chiralen Alkoholen benutzt. Durch die Verwendung von (S)-CBS oder (R)-CBS sind beide Enantiomere des Alkohols durch diese Reduktion möglich.[4][5][6]
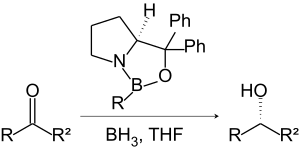 Reaktionsgleichung für die Corey-Bakshi-Shibata-Reaktion.
Reaktionsgleichung für die Corey-Bakshi-Shibata-Reaktion.
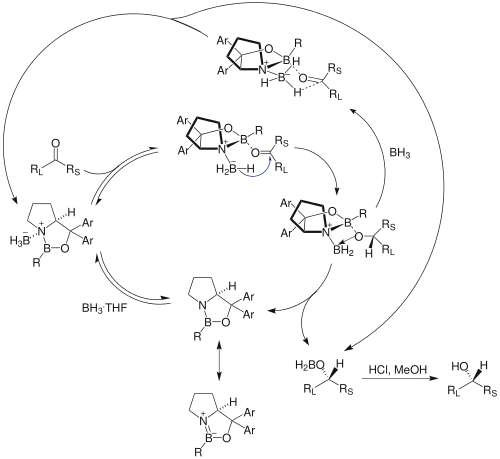
Das Reduktionsmittel, welches in stöchiometrischer Menge eingesetzt wird, ist Boran (BH3). Boran selbst reagiert mit Ketonen nur langsam und vor allem unselektiv. Der CBS-Katalysator dient zum einen der Aktivierung und zum anderen dem Bereitstellen einer chiralen Umgebung. Es handelt sich daher um eine sogenannte Liganden-beschleunigte Reaktion. Die Hydridquelle Boran wird durch Bindung an das Stickstoffatom des Katalysators und durch die Komplexierung an das Carbonyl-Sauerstoffatom aktiviert. Zunächst bildet sich ein Lewis-Säure-Base-Komplex aus dem CBS-Katalysator und der Carbonylgruppe. Die Elektrophilie der Carbonylgruppe wird dadurch genug angehoben, dass eine Reduktion mit Boran möglich ist. Nun können die Hydridatome nucleophil am Carbonyl-Kohlenstoffatom angreifen und die Reduktion ermöglichen. Der CBS-Katalysator sorgt für eine eindeutige Fixierung des Übergangszustandes und das Hydridion wird bevorzugt aus der sterisch bevorzugten Konformation angreifen.[7][8]
Einzelnachweise
- E. J. Corey, Raman K. Bakshi, Saizo Shibata: Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications. In: Journal of the American Chemical Society. 109, 1987, S. 5551, doi:10.1021/ja00252a056.
- Shinichi Itsuno, Akira Hirao, Seiichi Nakahama, Noboru Yamazaki: Asymmetric synthesis using chirally modified borohydrides. Part 1. Enantioselective reduction of aromatic ketones with the reagent prepared from borane and (S)-valinol. In: Journal of the Chemical Society, Perkin Transactions 1. 1983, S. 1673, doi:10.1039/P19830001673.
- Eintrag zu Corey-Itsuno-Reaktion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. September 2021.
- E. J. Corey, Saizo Shibata, Raman K. Bakshi: An efficient and catalytically enantioselective route to (S)-(–)-phenyloxirane. In: The Journal of Organic Chemistry. Band 53, Nr. 12, 1988, S. 2861–2863, doi:10.1021/jo00247a044.
- Lyndon C. Xavier, Julie J. Mohan, David J. Mathre, Andrew S. Thompson, James D. Carroll, Edward G. Corley, and Richard Desmond: (S)-Tetrahydro-1-Methyl-3,3-Diphenyl-1H,3H-Pyrrolo-[1,2-c][1,3,2]Oxazaborole-Borane Complex In: Organic Syntheses. 74, 1997, S. 50, doi:10.15227/orgsyn.074.0050; Coll. Vol. 9, 1998, S. 676 (PDF).
- Scott E. Denmark, Lawrence R. Marcin, Mark E. Schnute, and Atli Thorarensen: (R)-(−)-2,2-Diphenylcyclopentanol In: Organic Syntheses. 74, 1997, S. 33, doi:10.15227/orgsyn.074.0033; Coll. Vol. 9, 1998, S. 362 (PDF).
- Reaktionsmechanismus Corey-Bakshi-Shibata Reduction. In: Organic Chemistry Portal. Abgerufen am 2. Dezember 2018 (englisch).
- Beispiele für die CBS-Reduktion: Gerhard Bringmann, Matthias Breuning, Petra Henschel, and Jürgen Hinrichs: Asymmetric Synthesis of (M)-2-Hydroxymethyl-1-(2-Hydroxy-4,6-Dimethylphenyl)NNaphthalene via a configurationally unstable Biaryl Lactone In: Organic Syntheses. 79, 2002, S. 72, doi:10.15227/orgsyn.079.0072; Coll. Vol. 10, 2004, S. 448 (PDF).