Timolol
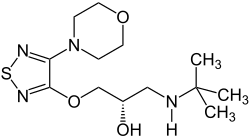
Timolol ist ein chiraler, enantiomerenreiner Arzneistoff aus der Gruppe der Betablocker und wird vor allem in Augentropfen zur Behandlung des Offenwinkelglaukoms (Grüner Star) eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Timolol | |||||||||||||||||||||
| Andere Namen |
(–)-(S)-1-(tert-Butylamino)-3-(4-morpholino-1,2,5-thiadiazol-3-yloxy)propan-2-ol | |||||||||||||||||||||
| Summenformel | C13H24N4O3S | |||||||||||||||||||||
| Kurzbeschreibung |
kristalliner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
nichtselektiver β-Adrenozeptor-Antagonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 316,42 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
71,5–72,5 °C[1] | |||||||||||||||||||||
| pKS-Wert |
9,4[2] | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologie
Timolol gehört zu der Gruppe der nichtselektiven Betablocker, da es nicht spezifisch an den β1-Adrenozeptoren bindet. Es weist keine intrinsische sympathomimetische Aktivität (ISA) auf. Timolol hemmt die β2-Adrenozeptoren des Ziliarkörpers des Auges und senkt daher die Produktion des Kammerwassers. Durch die verminderte Kammerwasserbildung kommt es zur Senkung des Augeninnendruckes. Die relative Wirkstärke des Timolol im Vergleich zum Propranolol beträgt 6.
Pharmakokinetik
Das fettlösliche Timolol wird nach oraler Aufnahme gut resorbiert, seine Bioverfügbarkeit beträgt etwa 50 bis 60 %. Die Plasmahalbwertszeit vom Timolol beträgt etwa 4 bis 5 Stunden. Es wird bis zu 80 % in der Leber metabolisiert. Die Plasmaproteinbindung von Timolol beträgt 60 %, es wird über die Nieren zu 30 % ausgeschieden.
Synthese
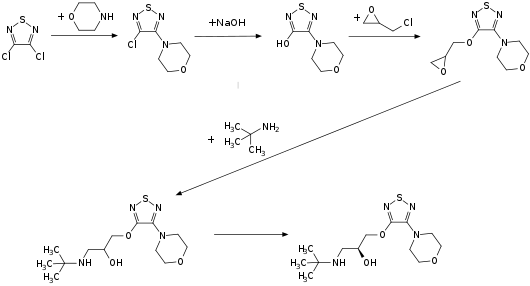
Es gibt mehrere Synthesewege für Timolol. Ausgehend von 3,4-Dichlor-1,2,5-thiadiazol und Morpholin wird in einem vierstufigen Verfahren zunächst racemisches Timolol erzeugt. Im ersten Schritt wird in einer nucleophilen Substitutionsreaktion die Morpholingruppe eingeführt. Nach der Umsetzung mit Natronlauge und Epichlorhydrin und Ringöffnung der Epoxyfunktion mit tert-Butylamin wird die racemische Zielverbindung erhalten. Die folgende Racematspaltung mit (+)-Weinsäure liefert dann (S)-Timolol, das als Arzneistoff eingesetzt wird. Alternativ kann enantiomerenreines Timolol auch aus D-Glycerinaldehyd – unter Vermeidung einer Racematspaltung – hergestellt werden.[5][6]
Handelsnamen
Arutimol (D), Betimol (A), Chibro-Timoptol (D), Dispatim (D), NyoGel (D), Nyolol (CH), zahlreiche Generika (D)
AZARGA (A), Combigan (D, CH), Cosopt (D, CH), DuoTrav (D, CH), Fotil (D), Ganfort (D, CH), TP-Ophtal (D), Xalacom (D, CH)
Literatur
- T. Karow / R. Lang-Roth: Allgemeine und spezielle Pharmakologie und Toxikologie. (2003) S. 62–66
- G. Herold: Innere Medizin (2004)
Einzelnachweise
- Eintrag zu Timolol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- V. Martinez, M.I Maguregui, R.M Jimenez, R.M Alonso: Determination of the pKa values of β-blockers by automated potentiometric titrations. In: Journal of Pharmaceutical and Biomedical Analysis. 23, 2000, S. 459–468, doi:10.1016/S0731-7085(00)00324-1.
- Eintrag zu Timolol in der DrugBank der University of Alberta, abgerufen am 7. Juni 2021.
- Datenblatt Timolol maleate salt bei Sigma-Aldrich, abgerufen am 7. Juni 2021 (PDF).
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert: Pharmaceutical Substances, 4. Auflage (2000) 2 Bände erschienen im Thieme-Verlag Stuttgart, S. 2043–2045, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Agosti, A.; Panzeri, S.; Gassa, F.; Magnani, M.; Forni, G.; Quaroni, M.; Feliciani, L.; Bertolini, G.: Continuous Safety Improvements to Avoid Runaway Reactions: The Case of a Chloro-Thiadiazole Intermediate Synthesis toward Timolol in Org. Process Res. Dev. 24 (2020) 1032–1042, doi:10.1021/acs.oprd.0c00048.