4-tert-Butylbenzoesäure
4-tert-Butylbenzoesäure (TBBA bzw. PTBBA) ist ein Alkylderivat der Benzoesäure und entsteht bei der Luftoxidation von 4-tert-Butyltoluol. Die Säure wird als Kettenabbruchreagenz bei Polykondensationsreaktionen, ihre Erdalkalisalze als Wärmestabilisatoren für PVC eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
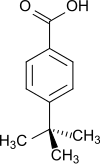 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 4-tert-Butylbenzoesäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C11H14O2 | |||||||||||||||
| Kurzbeschreibung |
weiße Flocken[1], weiße Schuppen[2], weißes-fast weißes Kristallpulver[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 178,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
0,057 Pa bei 20 °C[5] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 2 mg·m−3 (gemessen als einatembarer Staub)[8] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
4-tert-Butylbenzoesäure wird wegen ihrer toxikologischen Bedenklichkeit in Europa nicht mehr hergestellt.[5]
Darstellung
Das Standardverfahren zur Herstellung von 4-tert-Butylbenzoesäure ist die Oxidation von 4-tert-Butyltoluol (PTBT) in der Flüssigphase mit Luftsauerstoff unter Katalyse mit Cobaltsalzen, bevorzugt Cobalt(II)-acetat.[9][10]

Die Oxidation von 4-tert-Butyltoluol mit konzentrierter Salpetersäure bei 180 °C[11] ist wegen der Korrosivität heißer Salpetersäure und den in großen Mengen erzeugten nitrosen Gasen trotz guter Ausbeuten ebenso veraltet wie die Oxidation von PTBT mit Kaliumpermanganat.[12]
Eigenschaften
4-tert-Butylbenzoesäure fällt meist an als weißliches kristallines Pulver mit schwach aromatischem Geruch, das in Wasser bei neutralem pH-Wert löslich, im Sauren schwerlöslich ist. Die Säure löst sich in vielen organischen Lösungsmitteln ebenso wie im Alkalischen unter Salzbildung.
TBBA erwies sich in Tierversuchen als reprotoxisch und muss unter entsprechenden Vorsichtsmaßnahmen gehandhabt werden.
Verwendung
4-tert-Butylbenzoesäure findet Verwendung zur Modifizierung und Eigenschaftsverbesserung von Alkydharzen, als Kettenabbruchreagenz bei der Polyester-Polykondensation, als Nukleirungsmittel für Polypropylen und als Ausgangsmaterial für funktionalisierte Hydrazide als Extraktionsmittel für zweiwertige Kupfersalze[13], sowie für Methyl-4-tert-Butylbenzoat als Synthesebaustein für Avobenzon.
Salze der 4-tert-Butylbenzoesäure mit Alkalimetallen wie Kalium und mit Erdalkalimetallen wie Magnesium, Calcium und Barium werden bzw. wurden – meist als Kombinationen zweier Salze in flüssiger Form – zur thermischen Stabilisierung von flexiblem Weich-PVC eingesetzt.[14] Die als Stabilisatoren für starres Hart-PVC bisher gebräuchlichen Cadmium- und Bleisalze aromatischer und aliphatischer Carbonsäuren enthalten keine 4-tert-Butylbenzoesäure.
Salze von TBBA mit Aminen, wie z. B. mit Diethanolamin als Antioxidans und Korrosionsschutzmittel Kühlschmiermitteln und Schmierstoffen zugesetzt.[15]
Durch Hydrierung an einem hauptsächlich aus einem Gemisch von Lanthanoxid und Neodym(III)-oxid bestehenden Didym-Katalysator bei 400 °C wird aus TBBA 4-tert-Butylbenzaldehyd in 80%iger Ausbeute erhalten[16], der selbst mandelartig riecht und eine Ausgangsverbindung zur Synthese des Maiglöckchendufts Lilial darstellt.[17]
Einzelnachweise
- Datenblatt 4-tert-Butylbenzoesäure bei Sigma-Aldrich, abgerufen am 18. August 2015 (PDF).
- Eintrag zu 4-tert-Butylbenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Oktober 2021. (JavaScript erforderlich)
- Eintrag zu 4-tert-Butylbenzoic Acid bei TCI Europe, abgerufen am 21. August 2015.
- Datenblatt 4-tert-Butylbenzoesäure zur Synthese (PDF) bei Merck, abgerufen am 18. August 2015.
- ECHA Summary Risk Assessment Report: 4-tert-Butylbenzoic Acid, CAS No: 98-73-7, EINECS No: 202-696-3, Final Report 2009.
- http://www.ecem.com/msds/PTBBA_EN.pdf (Link nicht abrufbar)
- Eintrag zu 4-tert-butylbenzoic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 98-73-7 bzw. 4-tert-Butylbenzoesäure), abgerufen am 2. November 2015.
- G.W. Hearne, T.W. Evans, V.W. Buls, C.G. Schwarzer: Preparation of tert-Alkylbenzoic Acids by Liquid Phase Catalytic Oxidation. In: Ind. Eng. Chem. Band 47, Nr. 11, 1955, S. 2311–2313, doi:10.1021/ie50551a035.
- Patent US4603220: Process for the preparation of aromatic monocarboxylic acids from toluene and substituted toluenes. Angemeldet am 18. Juli 1984, veröffentlicht am 29. Juli 1986, Anmelder: Dynamit Nobel AG, Erfinder: M. Feld.
- Nanjing Jianci Chemical Plant Co., Ltd., Studies on Synthesizing P-Tert-Butyl Benzoic Acid(II), Nitric acid oxidation method.
- Nanjing Jianci Chemical Plant Co., Ltd., Studies on Synthesizing P-Tert-Butyl Benzoic Acid(III), Potassium permanganate oxidation method.
- D.A. Pashkina, V.Y. Gusev, A.V. Radushev: Physicochemical properties of 4-tert -butylbenzoic acid N ′,N ′-dialkylhydrazides. In: Russ. J. Gen. Chem. Band 84, Nr. 6, 2014, S. 1101–1105, doi:10.1134/S1070363214060085.
- espa, European Stabilizer Producers Association, Liquid stabilisers (Memento vom 26. Juli 2015 im Internet Archive).
- Patent US2832742: Corrosion inhibitor composition. Angemeldet am 9. Juni 1954, veröffentlicht am 29. April 1958, Anmelder: Alox Corp., Erfinder: C.A. Weltman.
- Patent EP101111: Process and catalytic composition for the preparation of aldehydes, and aldehydes thus prepared. Angemeldet am 13. Juli 1983, veröffentlicht am 22. Februar 1984, Anmelder: Shell Internationale Research Maatschaapij B.V., Erfinder: F. Wattimena, H.J. Heijman.
- P.N. Davey, S.A. Forsyth, H.Q.N. Gunaratne, C. Hardacre, A. McKeown, S.E.J. McMath, K.R. Seddon: Synthesis of 3-(4-tert-butylphenyl)-2-propen-1-one, a precursor to Lilial®, via an aldol condensation in an ionic liquid. In: Green Chemistry. Band 7, 2005, S. 224–229, doi:10.1039/B416021E.

