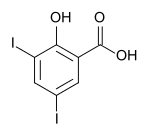
3,5-Diiodsalicylsäure
3,5-Diiodsalicylsäure ist eine organische chemische Verbindung, die sowohl zur Stoffgruppe der Phenole als auch zur Stoffgruppe der aromatischen Carbonsäuren gehört. Sie ist damit eine Phenolsäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 3,5-Diiodsalicylsäure | |||||||||||||||||||||
| Andere Namen |
3,5-Diiod-2-hydroxybenzoesäure | |||||||||||||||||||||
| Summenformel | C7H4I2O3 | |||||||||||||||||||||
| Kurzbeschreibung |
hellbraunes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 389,91 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
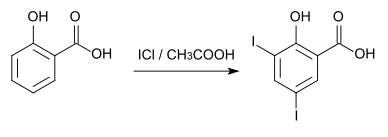
3,5-Diiodsalicylsäure kann aus Salicylsäure durch Iodierung mit Iodchlorid in Eisessig hergestellt werden.[4]
Ferner ist die Synthese aus Salicylsäure und elementarem Iod in ethanolischer Lösung durch Zugabe von Wasserstoffperoxid möglich.[5]
Toxizität
Im Tierversuch wurde festgestellt, dass 3,5-Diiodsalicylsäure nicht toxisch ist.[6]
Verwendung
3,5-Diiodsalicylsäure ist ein Ausgangsprodukt für die Herstellung von Rafoxanid[7], das als Medikament gegen Bandwurmbefall bei Haustieren eingesetzt wird.[8] In der Biochemie ist 3,5-Diiodsalicylsäure interessant, weil sie im Gegensatz zur unsubstituierten Salicylsäure eine stärkere Bindung zum Transthyretin aufweist.[9]
Reaktionen
Weitere Iodierung von 3,5-Diiodsalicylsäure in Gegenwart von Kaliumhydroxid schlägt fehl, es bildet sich unter Abspaltung der Säuregruppe 2,4,6-Triiodphenol.[3] 3,5-Diiodsalicylsäure färbt eine Eisen(III)-chloridlösung violett.[3]
Derivate
Acetylierung von 3,5-Diiodsalicylsäure führt zum Diiod-Aspirin, dessen blutgerinnungshemmende Wirkung größer ist als die des unsubstituierten Aspirins.[10] Die 3,5-Diiod-4-aminosalicylsäure, die durch Iodierung von 4-Aminosalicylsäure mit Iodchlorid in Eisessig hergestellt wird, wurde in der Behandlung von Tuberkulose eingesetzt.[11]
Salze
Die Natrium- und Ammoniumsalze der 3,5-Diiodsalicylsäure sind wasserlöslich.[12] Die Salze mit Seltenerdmetallen haben die allgemeine Formel X(I2Sal)3 · 5 H2O, wobei X = La, Ce, Pr, Nd, bzw. X(I2Sal)3 · 4 H2O, wobei X = Sm, Ho, Yb, Y.[12] Diese Salze sind in Wasser, Dimethylformamid, Dimethylsulfoxid und in unpolaren Lösungsmitteln nicht löslich, jedoch in Ethanol, Methanol und Aceton löslich.[12]
Das Kaliumsalz der 3,5-Diiodsalicylsäure ist mit der CAS-Nummer 17274-17-8 registriert, das Lithiumsalz unter CAS-Nummer 42935-32-0.
Die Trennung von der bei der Synthese als Zwischenprodukt entstehenden 5-Iodsalicylsäure ist über das Bariumsalz möglich, das sich bei der 5-Iodsalicylsäure gut in Wasser löst, hingegen ist das 3,5-Diiodsalicylat schwerlöslich.[3]
Einzelnachweise
- Datenblatt 3,5-Diiodsalicylsäure bei Sigma-Aldrich, abgerufen am 18. Juni 2017 (PDF).
- Datenblatt 3,5-Diiodsalicylsäure (PDF) bei Merck, abgerufen am 6. März 2010.
- Henry Watts: A dictionary of chemistry. 1868, S. 157 (eingeschränkte Vorschau in der Google-Buchsuche).
- G. H. Woollett and W. W. Johnson: 2-Hydroxy-3,5-Diiodobenzoic Acid In: Organic Syntheses. 14, 1934, S. 52, doi:10.15227/orgsyn.014.0052; Coll. Vol. 2, 1943, S. 343 (PDF).
- L. Jurd: The Iodination of aromatic compounds. IV. The Iodination of aromatic Hydrocarbons and Nuclear-substituted phenols, in: Australian Journal of Scientific Research, Series A: Physical Sciences, 1950, 3, S. 587. bibcode:1950AuSRA...3..587J.
- S. Mittler, G. H. Benham: Nutritional availability of iodine from several insoluble compounds, in: J. Nutrition, 1953, S. 53–58; (PDF; 296 kB).
- alchemchina.com: Pharmaceutical intermediates (Memento vom 20. Juni 2012 im Internet Archive), abgerufen am 19. November 2016.
- Eintrag zu Rafoxanide bei chemicalland21.com, abgerufen am 18. Juni 2017.
- L. Gales, M. R. Almeida, G. Arsequell, G. Valencia, M. J. Saraiva, A. M. Damas: Iodination of salicylic acid improves its binding to transthyretin. In: Biochimica et Biophysica Acta. Band 1784, Nummer 3, März 2008, S. 512–517, doi:10.1016/j.bbapap.2007.11.014, PMID 18155178.
- T. J. Mende: Enhancement of the antihemostatic effect of acetylsalicylic acid by ring iodination, in: Pharmacology, 1972, 7, S. 249–254; doi:10.1159/000136295.
- D. S. Bhate, T. B. Panse, K. Venkataraman: Antitubercular compounds, Part II, 3,5-Diiodo-4-aminosalicylic acid, 4-Amino-O-acetylsalicylic acid and other derivatives of 4-Aminosalicylic acid, 1950; 32: 357. doi:10.1007/BF03172507 (PDF; 133 kB).
- D. K. Koppikar, S. Soundararajan: „Diiodosalicylates of the rare earths“, in: Curr. Sci., 1976, 45 (1), S. 3; (PDF; 237 kB).