2-Methyltetrahydrofuran
2-Methyltetrahydrofuran (2-MTHF) ist ein organisches Lösungsmittel und gehört zur Stoffklasse der cyclischen Ether.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
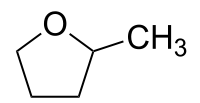 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methyltetrahydrofuran | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,85 g·cm−3 (Racemat)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
80 °C (Racemat)[1] | ||||||||||||||||||
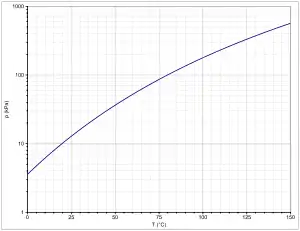
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4059 (21 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
4500 mg·kg−3 (LD50, Kaninchen, transdermal)[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
2-Methyltetrahydrofuran entsteht als Nebenprodukt bei der industriellen Produktion von Furfurylalkohol aus Furfural.[5] Es kann auch durch eine Nickel-katalysierte Hydrierung von 2-Methylfuran hergestellt werden.[5] Dieses kann aus dem durch Aufarbeitung pflanzlicher Pentosen zugänglichen Furfural gewonnen werden, so dass die Herstellung von 2-Methyltetrahydrofuran insgesamt aus nachwachsenden Rohstoffen erfolgen kann.
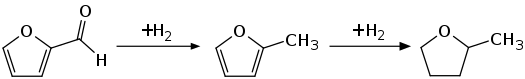
Ein neueres Verfahren geht über die Zyklisierung und Hydrierung von Levulinsäure, die ebenfalls aus Kohlenhydraten gewonnen werden kann.[5][6] Alle kommerziellen Herstellprozesse ergeben das Racemat. Eine Enantiomerentrennung kann chromatographisch an chiralen stationären Phasen mit überkritischen Medien erfolgen.[7][8] Die Synthese des (S)-(+)-2-Methyltetrahydrofurans gelingt durch die Hydrierung von 2-Methylfuran mittels chiraler Rhodiumkomplex-Katalysatoren.[9]
Eigenschaften
Stereochemie
Die Verbindung enthält ein Stereozentrum und kann somit in Form zweier Enantiomere auftreten. Praktische Bedeutung hat allerdings nur das Racemat.
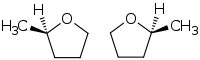
- (R)-Enantiomer (links), (S)-Enantiomer (rechts)
Physikalische Eigenschaften
2-Methyltetrahydrofuran ist eine farblose, niedrigviskose Flüssigkeit mit charakteristischem Geruch. Der Siedepunkt bei Normaldruck beträgt 80,3 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in °C) mit A = 5,95009, B = 1175,51 und C = 217.80.[10][11] Die folgende Tabelle gibt einen Überblick über wichtige thermodynamische Eigenschaften.
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Wärmekapazität cp 156,89 J·mol−1·K−1 (25 °C)[12]
1,82 J·g−1·K−1 (25 °C)[12]Kritische Temperatur Tc 537 K[13][14] Kritischer Druck pc 37,6763 bar[13][14] Kritisches Volumen Vc 0,267 l·mol−1[13][14] Kritische Dichte ρc 0,3226 g·ml−1[14] Azentrischer Faktor ωc 0,300[14] Verdampfungsenthalpie ΔVH0
ΔVH34,0 kJ·mol−1[15]
30,43 kJ·mol−1[16]
am Siedepunkt
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der vereinfachten Watsongleichung ΔVH=A·(1−Tr)n (ΔVH in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 45,7503 kJ/mol, n = 0,38 und Tc = 537,0 K im Temperaturbereich zwischen 136 K und 537 K beschreiben.[16]
Mit einem Wassergehalt von 10,6 Ma% bildet die Verbindung ein bei 71 °C siedendes Azeotrop. Weitere azeotrop siedende Gemische werden mit Methanol, Ethanol, 1-Propanol und 2-Propanol gebildet.[2]
| Azeotrope mit verschiedenen Lösungsmitteln[2] | ||||||||||||
| Lösungsmittel | Methanol | Ethanol | 1-Propanol | 2-Propanol | Wasser | |||||||
| Gehalt Methyltetrahydrofuran | in Ma% | 43 | 66 | 99 | 82 | 89,4 | ||||||
| Siedepunkt | in °C | 62,8 | 74,4 | 79,5 | 77 | 71 | ||||||
Bei 20 °C lösen sich in 100 g Wasser 14 g Methyltetrahydrofuran, umgekehrt lösen sich 4 g Wasser in 100 g Methyltetrahydrofuran.[2] Die Löslichkeit von Wasser in 2-Methyltetrahydrofuran ändert sich nur wenig mit steigender Temperatur. Dagegen sinkt die Löslichkeit von Methyltetrahydrofuran in Wasser mit steigender Temperatur.[17]
| Löslichkeiten im System 2-Methyltetrahydrofuran - Wasser[18][17] | ||||||||||||
| Temperatur | in °C | 0,0 | 9,5 | 19,3 | 29,5 | 39,6 | 50,1 | 60,7 | 70,6 | |||
| Löslichkeit von Wasser in Methyltetrahydrofuran | in Ma% | 4,0 | 4,1 | 4,1 | 4,2 | 4,3 | 4,4 | 4,6 | 5,0 | |||
| Löslichkeit von Methyltetrahydrofuran in Wasser | in Ma% | 21,0 | 17,8 | 14,4 | 11,4 | 9,2 | 7,8 | 6,6 | 6,0 | |||
Sicherheitstechnische Kenngrößen
2-Methyltetrahydrofuran bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −12 °C.[19][1] Der Explosionsbereich liegt zwischen 1,5 Vol.‑% als untere Explosionsgrenze (UEG) und 8,9 Vol.‑% als obere Explosionsgrenze (OEG).[20][17] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −15 °C sowie einen oberen Explosionspunkt von 18 °C. Die Sauerstoffgrenzkonzentration liegt bei 100 °C bei 9,4 Vol%.[21] Die Zündtemperatur beträgt 270 °C.[20][17] Der Stoff fällt somit in die Temperaturklasse T3.
Chemische Eigenschaften
2-Methyltetrahydrofuran neigt in Gegenwart von Luft wie viele andere Ether zur Bildung von Peroxiden.[1] Die Geschwindigkeit der Peroxidbildung ist ähnlich der von Tetrahydrofuran.[2] Das handelsübliche Produkt enthält Butylhydroxytoluol als Stabilisator. Gegenüber Säuren ist es wesentlich stabiler als Tetrahydrofuran.[2]
Verwendung
2-Methyltetrahydrofuran wird als Lösungsmittelaltenative zum Tetrahydrofuran besonders bei metallorganischen Reaktionen gesehen.[2] Zum einen besitzt es auch bei niedrigen Temperaturen wie −70 °C mit 1,85 cp eine niedrige Viskosität[22], zum anderen kann der Temperaturbereich bis zum höheren Siedepunkt von 80 °C genutzt werden.[2] Da die Verbindung beim Abkühlen unterhalb des Schmelzpunktes glasartig erstarrt, kann es als Lösungsmittel bei spektroskopischen Untersuchungen bei −196 °C genutzt werden.[23] Eine Verwendung als Verschnittkomponente in Motorenbenzin wurde in den USA erfolgreich getestet.[11] In der organischen Chemie wird es als Reaktant für die Herstellung N-substituierter 2-Methylpyrrolidine verwendet.[11]
Einzelnachweise
- Eintrag zu Tetrahydro-2-methylfuran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Januar 2020. (JavaScript erforderlich)
- Aycock, D.F.: Solvent Applications of 2-Methyltetrahydrofuran in Organometallic and Biphasic Reactions in Org Process Res Dev. 11 (2007) 156–159, doi:10.1021/op060155c
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-376.
- Datenblatt 2-Methyltetrahydrofuran, anhydrous, ≥ 99 %, Inhibitor-free bei Sigma-Aldrich, abgerufen am 8. April 2012 (PDF).
- Hoydonckx, H.E.; van Rhijn, V.M.; van Rhijn, W.; de Vos, D.E. Jacobs, P.A.: Furfural and Derivatives in Ullmanns Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a12_119.pub2.
- Lichtenthaler, F.W.: Carbohydrates as Organic Raw Materials in Ullmanns Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.n05_n07.
- Schurig, V.; Schmalzing, D.; Schleimer, M.: Enantiomerentrennung an immobilisiertem Chirasil-Metall und Chirasil-Dex durch Gaschromatographie und Chromatographie mit überkritischen Gasen in Angew. Chem. 103 (1991) 994–996, doi:10.1002/ange.19911030822.
- Schurig, V.; Buerkle, W.: Extending the scope of enantiomer resolution by complexation gas chromatography in J. Am. Chem. Soc. 104 (1982) 7573–7580, doi:10.1021/ja00390a031.
- He, Man; Zhou, Da-Qing; Ge, Hong-Li; Huang, Mei-Yu; Jiang, Ying-Yan: Catalytic Behavior of Wool-Rh Complex in Asymmetric Hydrogenation of 2-Methyl Furan in Polymer Adv. Techn. 14 (2003) 273–277, doi:10.1002/pat.305.
- S. Rodrı́guez, H. Artigas, C. Lafuente, A. M. Mainar, F. M Royo: Isobaric vapour–liquid equilibrium of binary mixtures of some cyclic ethers with chlorocyclohexane at 40.0 and 101.3 kPa. In: Thermochimica Acta. Band 362, Nr. 1-2, 2000, S. 153–160, doi:10.1016/S0040-6031(00)00580-3.
- V. K. Rattan, B. K. Gill, S. Kapoor: Isobaric Vapor-Liquid Equilibrium Data for Binary Mixture of 2-Methyltetrahydrofuran and Cumene. In: International Journal of Chemical and Molecular Engineering. Band 2, Nr. 11. World Academy of Science, Engineering and Technology, 2008, S. 41–44 (waset.org).
- Rodriguez, R.; Lafuente, C.; Artigas, H.; Royo, F.M.; Urieta, J.S.: Thermodynamic Densities, speeds of sound, and isentropic compressibilities of a cyclic ether with chlorocyclohexane, or bromocyclohexane at the temperatures 298.15K and 313.15K in J. Chem. Thermodyn. 31 (1999) 139–149, doi:10.1006/jcht.1998.0437.
- Kobe, K.A.; Ravicz, A.E.; Vohra, S.P.: Critical Properties and Vapor Pressures of Some Ethers and Heterocyclic Compounds in J. Chem. Eng. Data 1 (1956) 50–56, doi:10.1021/i460001a010.
- Carl L. Yaws, Prasad K. Narasimhan: Thermophysical Properties of Chemicals and Hydrocarbons - Chapter 1: Critical Properties and Acentric Factor, Organic Compounds, 1st Edition Elsevier 2008, ISBN 978-0-8155-1596-8, S. 18, doi:10.1016/B978-081551596-8.50006-7.
- Stephenson, R.M.; Malanowski, S.: Handbook of the Thermodynamics of Organic Compounds, 1987, doi:10.1007/978-94-009-3173-2.
- Carl L. Yaws, Marco A. Satyro: Thermophysical Properties of Chemicals and Hydrocarbons - Chapter 7: Enthalpy of Vaporation, Organic Compounds, 1st Edition Elsevier 2008, ISBN 978-0-8155-1596-8, S. 325, doi:10.1016/B978-081551596-8.50012-2.
- Datenblatt der Firma PENN Specialty Chemicals, Inc., pdf (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, doi:10.1021/je00005a024.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- Watanabe, K.; Yamagiwa, N.; Torisawa, Y.: Cyclopentyl Methyl Ether as a New and Alternative Process Solvent in Org. Process Res. Dev. 11 (2007) 251–258, doi:10.1021/op0680136
- Osterberg, P.M.; Niemeier J.K.; Welch,C.J.; Hawkins, J.M.; Martinelli, J.R.; Johnson, T.E.; Root, T.W.; Stahl, S.S.: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry in Org. Process Res. Dev. 19 (2015) 1537–1542, doi:10.1021/op500328f
- Nicholls, D.; Sutphen, C.; Szware, M: Dissociation of lithium and sodium salts in ethereal solvents in J. Phys. Chem. 72 (1968) 1021–1027, doi:10.1021/j100849a041.
- Bublitz, G.; Boxer, S.: Effective Polarity of Frozen Solvent Glasses in the Vicinity of Dipolar Solutes in J. Am. Chem. Soc. 120 (1998) 3988–3992, doi:10.1021/ja971665c.


