Butylhydroxytoluol
Butylhydroxytoluol (BHT) ist eine chemische Verbindung aus den Gruppen der Toluolderivate bzw. der Phenole, die industriell in erheblichen Mengen hergestellt und verwendet wird. Phytoplankton wie die Grünalge Botryococcus braunii und die Cyanobakterien Cylindrospermopsis raciborskii, Microcystis aeruginosa und Oscillatoria sp. bilden BHT, wie durch GC-MS nachgewiesen wurde.[7]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
_Structural_Formula_V1.svg.png.webp) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Butylhydroxytoluol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C15H24O | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 220,35 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,05 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
265 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4859 (75 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
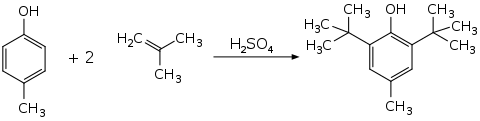
BHT kann in einer Friedel-Crafts-Alkylierung durch Reaktion von p-Kresol (4-Methylphenol) mit Isobutylen (2-Methylpropen) hergestellt werden, wobei Schwefelsäure als Katalysator dient:[8]
Butylhydroxytoluol zählt zu den chemischen Substanzen, die in großen Mengen hergestellt werden („High Production Volume Chemical“, HPVC) und für die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) eine Datensammlung zu möglichen Gefahren („Screening Information Dataset“, SIDS) angefertigt wurde.[9]
Verwendung
BHT wird in zahlreichen Verbraucherprodukten, z. B. Farben, Wachsen, Kosmetika, Arzneimitteln oder Verpackungsmaterialien, und auch als zugelassener Lebensmittelzusatzstoff unter der Bezeichnung E 321 eingesetzt.[4] Es dient vor allem als Antioxidans, um Veränderungen von Produkten durch Luftsauerstoff zu verhindern oder zu verlangsamen. Sein Zusatz als Stabilisator zu Diethylether oder Tetrahydrofuran verhindert die Bildung gefährlicher Etherperoxide.
Außerdem dient es der Stabilisierung von Biodiesel.[10]
In den 1980er-Jahren wurde die Wirksamkeit von BHT gegen Herpes-simplex-Viren in Hamstern festgestellt.[11] Allergische Reaktionen der Testpersonen gegen BHT verhinderten aber eine weitere Nutzung in diesem Bereich.
Analytik
Zur Isolierung der Substanz aus Ölen und fetthaltigen Untersuchungsmaterialien kann die lipophile Gelchromatographie an Sephadex LH 20 eingesetzt werden. Die qualitative und quantitative Bestimmung kann durch Gaschromatographie erfolgen.[12] Auch die Kopplung der HPLC mit der Massenspektrometrie kann nach angemessener Probenvorbereitung zur qualitativen und quantitativen Bestimmung von BHT eingesetzt werden.[13]
Sicherheitshinweise/Toxikologie
In einer Übersichtsarbeit wurden Tierversuche mit hoher Dosierung von BHT beschrieben: Es traten Störungen der Blutgerinnung auf, und im Langzeitversuch wurden Lebertumore beobachtet.[14] Die Internationale Agentur für Krebsforschung (IARC) hat BHT als nicht klassifizierbar eingestuft.
Butylhydroxytoluol wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Butylhydroxytoluol waren die Besorgnisse bezüglich Exposition empfindlicher Bevölkerungsgruppen, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie als potentieller endokriner Disruptor. Die Neubewertung läuft seit 2016 und wird von Frankreich durchgeführt.[15]
Siehe auch
- Butylhydroxyanisol (E 320)
Einzelnachweise
- Eintrag zu E 321: Butylated hydroxytoluene (BHT) in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu BHT in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Eintrag zu 2,6-Di-tert-butyl-p-kresol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Juni 2018. (JavaScript erforderlich)
- Eintrag zu Butylhydroxytoluol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. August 2017.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-148.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 128-37-0 bzw. Butylhydroxytoluol), abgerufen am 2. November 2015.
- B. Babu, J. T. Wu: Production of Natural Butylated Hydroxytoluene as an Antioxidant by Freshwater Phytoplankton. In: Journal of Phycology. Band 44, Nr. 6, Dezember 2008, S. 1447–1454, doi:10.1111/j.1529-8817.2008.00596.x, PMID 27039859 (edu.tw [PDF]).
- Helmut Fiege, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Tadao Iwata, Hisaya Miki, Yasuhiro Fujita, Hans-Josef Buysch, Dorothea Garbe, Wilfried Paulus: Phenol Derivatives. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002. doi:10.1002/14356007.a19_313 Article Online Posting Date: June 15, 2000.
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für 2,6-Di-tert-butyl-p-cresol, abgerufen am 3. Oktober 2014.
- Patent EP1563041: Verwendung von 2,6-Di-tert.-butyl-p-kresol zur Erhöhung der Lagerstabilität von Biodiesel. Angemeldet am 8. Juli 2003, veröffentlicht am 2. Juli 2008, Anmelder: Lanxess, Erfinder: Axel Ingendoh, Christian Rother, Klaus-Peter Heise.
- James T. Richards, Mary Ellen Katz, Earl R. Kern: Topical butylated hydroxytoluene treatment of genital herpes simplex virus infections of guinea pigs. In: Antiviral Research. Band 5, Nr. 5, Oktober 1985, S. 281–290, doi:10.1016/0166-3542(85)90042-7.
- H.-U. Melchert: Lipophile Gelchromatographie zur Isolierung von BHA und BHT aus Pflanzenölen. In: Chem. Mikrobiol. Technol. Lebensm. 2, 1973, S. 94–85.
- R. Liu, T. Ruan, S. Song, Y. Lin, G. Jiang: Determination of synthetic phenolic antioxidants and relative metabolites in sewage treatment plant and recipient river by high performance liquid chromatography-electrospray tandem mass spectrometry. In: J Chromatogr A. 1381, 13. Feb 2015, S. 13–21. PMID 25614188.
- Regine Kahl, Hermann Kappus: Toxikologie der synthetischen Antioxidantien BHA und BHT im Vergleich mit dem natürlichen Antioxidans Vitamin E. In: Zeitschrift für Lebensmitteluntersuchung und -Forschung A. Band 196, Nr. 4, 1. April 1993, S. 329–338, doi:10.1007/BF01197931.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2,6-di-tert-butyl-p-cresol, abgerufen am 26. März 2019.
