Ethylamin
Ethylamin ist eine organisch-chemische Verbindung aus der Stoffgruppe der aliphatischen primären Amine. Es kommt als 50 bzw. 70%ige wässrige Lösung in den Handel. Ethylamin ist ein wichtiges Zwischenprodukt der Chemischen Industrie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
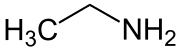 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylamin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H7N | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem, aminartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 45,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
2,162 g·m−3 (0 °C, 1013 mbar) | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
16,6 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
10,75 (25 °C)[3] | ||||||||||||||||||
| Löslichkeit |
beliebig mischbar in Wasser, Ethanol und Diethylether[1] | ||||||||||||||||||
| Brechungsindex |
1,3663[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−47,5 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Die großtechnische Herstellung von Ethylamin erfolgt durch Umsetzung von Ethanol mit Ammoniak bei Temperaturen von 180–220 °C und Drücken von 20–70 bar in Gegenwart von Wasserstoff an einem kupfer-, nickel- oder kobalthaltigen Katalysator, welcher mit Metalloxiden wie Siliciumdioxid oder Aluminiumoxid geträgert ist. Die komplette Reaktion läuft dabei bevorzugt in der Gasphase in Rohr- oder Rohrbündelreaktoren ab. Der Katalysator wird dabei als Festbett angeordnet.[7]
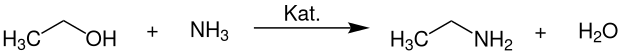
Als Nebenprodukte werden neben Wasser auch noch Diethylamin und Triethylamin gebildet, die durch mehrstufige Destillation unter Druck in Rektifikationskolonnen abgetrennt werden müssen. Bevorzugt wird anstelle des herkömmlichen Ethanols, auch sogenannter Bioethanol, welcher durch biotechnologische Fermentation gewonnen wurde, eingesetzt.[7]
Ethylamin kann auch durch katalytische Hydrierung von Acetonitril, Acetamid oder Nitroethan hergestellt werden. Des Weiteren ergibt die Umsetzung von Ethen mit Ammoniak unter Basenkatalyse (z. B. Natriumamid) ebenfalls Ethylamin. Außerdem kann Ethylamin durch nucleophile Substitution von Halogenalkanen (wie z. B. Chlorethan oder Bromethan) mit Ammoniak unter Verwendung einer starken Base wie Kaliumhydroxid synthetisiert werden. Diese Verfahren sind jedoch nicht wirtschaftlich und finden daher keine großtechnische Anwendung.
Eigenschaften
Physikalische Eigenschaften
Ethylamin hat einen Schmelzpunkt von −81 °C und einen Siedepunkt von 16,6 °C. Die kritische Temperatur beträgt 183,4 °C, der kritische Druck 56,3 bar und die kritische Dichte 0,248 g/cm³. Der Flammpunkt liegt bei −37 °C und die Zündtemperatur bei 385 °C. Bei 20 °C weist Ethylamin einen Dampfdruck von 1,144 bar auf.[2]
Chemische Eigenschaften
Ethylamin gehört zur Stoffgruppe der aliphatischen Amine und liegt bei Raumtemperatur als farbloses Gas mit aminartigem Geruch vor. Das extrem entzündbare Gas bildet mit Luft explosive Gemische und ist schwerer als Luft. In Wasser löst es sich unter Hydrolyse. Die Lösungen von Ethylamin reagieren stark alkalisch. Von diesem Stoff gehen ebenfalls akute oder chronische Gesundheitsgefahren aus. Durch Reaktion mit anderen Stoffen kann es zur Bildung von nitrosen Gasen kommen. Ethylamin wirkt auf verschiedene polymerisierbare Substanzen als Initiator.[2]
Verwendung
Ethylamin ist ein vielseitiges Zwischenprodukt der chemischen Industrie mit verschiedenen Anwendungsmöglichkeiten. Die Hauptanwendung von Ethylamin ist die Weiterverarbeitung zu Pflanzenschutzmitteln (z. B. Atrazin und Simazin). Monoethylamin findet außerdem Anwendung bei der Herstellung von Bergbauchemikalien wie Flotationsmittel (z. B. Isopropylethylthiocarbamat) sowie bei der Produktion von Polyurethanschaumstoffen als Verkettungsstopper zur Steuerung des Polymerisierungsvorgangs.[8] Es ist Ausgangsstoff für die Synthese von Farbstoffen, Pharmazeutika und Herbiziden.[1]
Sicherheitshinweise
Ethylamin ist ein extrem entzündbares Gas, welches mit Luft explosive Gemische bildet. Es wird hauptsächlich durch den Atemtrakt aufgenommen. Des Weiteren wird eine gute Resorption über die Schleimhäute und die Haut vermutet. Nach Aufnahme des Gases ist eine stark reizende bis ätzende Wirkung auf Schleimhäute und Haut zu erwarten, chronisch kann es zu irritative Wirkungen auf die Schleimhäute sowie zur Störungen des Allgemeinbefindens kommen. Reproduktionstoxizität, Mutagenität und Kanzerogenität wurden in Tests nicht bestätigt, jedoch kann Ethylamin mit anderen Stoffen zu kanzerogenen Verbindungen reagieren. Ethylamin weist eine untere Explosionsgrenze von 3,50 Vol.-% bei 65 g·cm−3 und eine obere Explosionsgrenze von 14,0 Vol.-% bei 260 g·cm−3 auf. Die Zündtemperatur beträgt 385 °C. Der Stoff fällt somit in die Temperaturklasse T2. Mit einem Flammpunkt von −37 °C gilt Ethylamin als extrem leicht entflammbar.[2]
Einzelnachweise
- Eintrag zu Ethylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Dezember 2018.
- Eintrag zu Ethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Dezember 2018. (JavaScript erforderlich)
- Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut: Amines, Aliphatic. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, 2000, ISBN 978-3-527-30673-2, doi:10.1002/14356007.a02_001.
- Eintrag zu Ethylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 28. August 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- Norbert Asprion, Manfred Julius, Oliver Bey, Stefanie Werland, Frank Stein, Matthias Kummer, Wolfgang Mägerlein, Johann-Peter Melder, Kevin Huyghe, Maarten Moors: Verfahren zur Herstellung von Ethylaminen und Mono-iso-propylamin (MIPA). In: Google Patents. BASF SE, 21. Oktober 2015, abgerufen am 8. April 2019.
- BASF SE: Ethylamin. In: BASF Produktsuche. BASF SE, abgerufen am 6. Dezember 2018.

