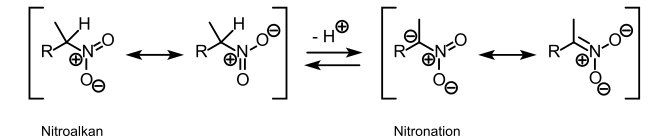
Nitroalkane
Nitroalkane (auch Nitroparaffine) sind chemische Verbindungen die aus einem aliphatischen Kohlenwasserstoff-Gerüst bestehen, bei dem ein oder mehrere Wasserstoffatome durch eine Nitrogruppe (–NO2) ersetzt sind. Je nach Stellung der Nitrogruppe innerhalb des Moleküls werden primäre, sekundäre und tertiäre Nitroalkane unterschieden.
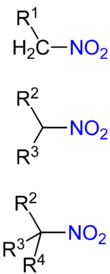
Nomenklatur
In der aktuellen chemischen Nomenklatur weist das Präfix Nitro- auf eine Kohlenstoff-gebundene NO2-Gruppe hin. Es sind jedoch noch irreführende historische oder Trivialnamen gebräuchlich, wie beispielsweise Nitroglycerin: Hier ist der Alkylrest über ein verbrückendes Sauerstoffatom an den Stickstoff gebunden, weswegen es sich nicht um ein Nitroalkan, sondern um einen Triester der Salpetersäure handelt.
Synthese
Im Labor gewinnt man die primären und sekundären Nitroalkane meist durch Umsetzung der Alkyliodide mit Natriumnitrit in Dimethylformamid-Lösung bei Gegenwart von Harnstoff. Die tertiären Nitroalkane sind durch Oxidation tertiärer Alkylamine mit Kaliumpermanganat zugänglich.[1]
Eigenschaften
Die Schmelz- und Siedepunkte von einfachen aliphatischen Nitroalkanen sind höher als diejenigen entsprechender Alkane oder Alkohole (siehe Tabelle).
Substanz Schmelzpunkt Siedepunkt Methan CH4 −183 °C −161 °C Methanol CH3OH −98 °C 65 °C Nitromethan CH3NO2 −29 °C 101 °C Ethan CH3CH3 −172 °C −88 °C Ethanol CH3CH2OH −114 °C 78 °C Nitroethan CH3CH2NO2 −90 °C 114 °C Propan CH3CH2CH3 −188 °C −42 °C Propan-1-ol CH3CH2CH2OH −127 °C 97 °C 1-Nitropropan CH3CH2CH2NO2 −108 °C 131 °C Propan-2-ol CH3CH(OH)CH3 −90 °C 82 °C 2-Nitropropan CH3CH(NO2)CH3 −93 °C 120 °C Butan CH3CH2CH2CH3 −138 °C −0,5 °C Butan-1-ol CH3CH2CH2CH2OH −90 °C 117 °C 1-Nitrobutan CH3CH2CH2CH2NO2 −81 °C 152 °C
Substanz pKa Nitromethan CH3NO2 10,2[2] Nitroethan CH3CH2NO2 8,6[3] 1-Nitropropan CH3CH2CH2NO2 9[3] 2-Nitropropan CH3CH(NO2)CH3 7,74[3]
Die Nitrogruppe übt einen negativen induktiven Effekt auf das Kohlenstoffatom aus, das sie trägt. Nitroalkane, die am α-Kohlenstoffatom (dem der Nitrogruppe benachbarten Kohlenstoffatom) ein Wasserstoffatom enthalten, sind CH-acide Verbindungen. Das bei Deprotonierung entstehende Anion kann sowohl durch diesen induktiven Effekt, als auch durch Delokalisation der Ladung durch Mesomerie stabilisiert werden. Als Folge davon sind primäre und sekundäre Nitroalkane relativ stark sauer und können einfach basisch deprotoniert werden. Die so gebildeten Carbanionen sind reaktive Zwischenstufen für die präparativ interessante Knüpfung von neuen Kohlenstoff-Kohlenstoff-Bindungen.
Reaktionen
Die Umwandlung von Nitrogruppen in Carbonylgruppen wird als Nef-Reaktion bezeichnet:
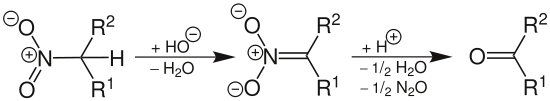 Reaktionsgleichung der Nef-Reaktion
Reaktionsgleichung der Nef-Reaktion
Diese Reaktion ist auf drei Arten möglich:[4]
- Säure-Base Methode: Nitronatsalz das vorgängig gebildet wurde, wird in eine starke wässrige Säure gegeben (Standard Verfahren)
- Oxidative Methoden
- Reduktive Methoden
Siehe auch
- Tetranitromethan, C(NO2)4
Einzelnachweise
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 949.
- Autorenkollektiv, Organikum, 16. Aufl., VEB Deutscher Verlag der Wissenschaften, Berlin, 1986, S. 442.
- pKa Data Compiled by R. Williams (Memento vom 1. August 2012 im Internet Archive) (13. Dezember 2008).
- organic-chemistry.org: Nef Reaction (13. Dezember 2008).