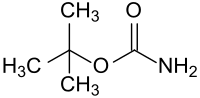
tert-Butylcarbamat
tert-Butylcarbamat (Boc-amin) ist das einfachste Boc-geschützte Amin und erlaubt in Gegenwart von Palladium-Komplexen – über die Zwischenstufe des (hetero)aromatischen tert-Butylcarbamats – die direkte Einführung einer NH2-Gruppe in Halogenaromaten oder Aryl-triflate unter schonenden Bedingungen im Sinne einer Buchwald-Hartwig-Kupplung.[6][7]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | tert-Butylcarbamat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H11NO2 | |||||||||||||||
| Kurzbeschreibung |
beiger[1] bis weißer kristalliner Feststoff[2] bzw. weiße Nadeln[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 117,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
196 °C[4] | |||||||||||||||
| Löslichkeit |
löslich in Dichlormethan, Chloroform und Alkoholen[4], in DMF[5] | |||||||||||||||
| Brechungsindex |
1,428[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen und Darstellung
tert-Butylcarbamat wird bei der Reaktion von tert-Butanol und Natriumcyanat in Benzol oder Dichlormethan und in Gegenwart von Trifluoressigsäure[8] in einer Reinausbeute von 69 % erhalten.
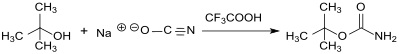
Nach einer ausgearbeiteten Laborvorschrift[3] werden Ausbeuten von 76 bis 94 % erzielt. Die Verwendung von Natriumcyanat ist kritisch; Kaliumcyanat liefert das Produkt nur in 5%iger Ausbeute.
Die Umsetzung von Di-tert-butyldicarbonat mit Ammoniak in Ethanol erzeugt tert-Butylcarbamat in 98%iger Rohausbeute.[5]
Eigenschaften
tert-Butylcarbamat ist ein weißer, volatiler,[3] kristalliner Feststoff, der sich in Chlorkohlenwasserstoffen und Alkoholen löst.[4]
Anwendungen
Synthese von stickstoffhaltigen Heterocyclen
Ein einfacher Zugang zu 3-Pyrrolinen eröffnet die Reaktion von tert-Butylcarbamat mit cis-1,4-Dichlor-2-buten in Gegenwart der Base Natriumhydrid in DMF, bei der das Boc-geschützte 3-Pyrrolin in 60%iger Ausbeute gebildet wird.[5]

Hochsubstituierte Pyrrole lassen sich analog durch Umsetzung von 1,4-Dihalogen-1,3-dienen mit tert-Butylcarbamat in Gegenwart des Katalysators Kupfer(I)-iodid, des Kupferliganden N,N'-Dimethylethylendiamin (DMEDA) und der Base Caesiumcarbonat in Tetrahydrofuran als Lösungsmittel mit sehr hohen Ausbeuten darstellen.[9]
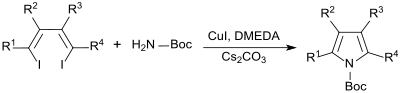
Auch auf anderen Syntheserouten schwer zugängliche Heteroarylpyrrole, wie z. B. Thienopyrrole, können auf diesem Weg in guten Ausbeuten erhalten werden.[9]

Für die Umsetzung ist die Stellung der Halogenatome an der Doppelbindung (cis- oder trans-Konfiguration) unerheblich.
Mehrfach substituierte Pyrrole sind auch durch eine Eintopfreaktion von sekundären Propargylalkoholen mit 1,3-Dicarbonylverbindungen, wie z. B. Acetessigsäureethylester und tert-Butylcarbamat in Gegenwart von Ruthenium-Katalysatoren und Trifluoressigsäure TFA in brauchbaren Ausbeuten (60 bis 80 %) zugänglich.[10]

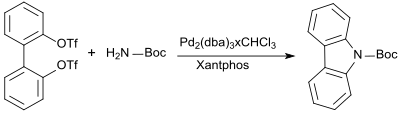
Auch Carbazole können aus dem durch Suzuki-Miyaura-Kupplung einfach erhältlichen 2,2'-Biphenylyl-ditriflat und tert-Butylcarbamat in Gegenwart von Palladiumverbindungen und des Phosphinliganden Xantphos dargestellt werden.[11]
Substitution von Halogenatomen an halogenierten Heteroaromaten und an Halogenaromaten
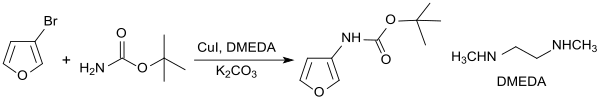
An elektronenreichen Heterocyclen, wie z. B. 3-Bromfuran, lässt sich das Bromatom mittels tert-Butylcarbamat in einer Kupfer(I)-iodid-katalysierten Reaktion in Gegenwart des Liganden DMEDA praktisch quantitativ durch eine Boc-geschützte Aminogruppe ersetzen.[12]
Die Substitution von Halogenatomen an Halogenaromaten durch eine Boc-geschützte Aminogruppe mittels tert-Butylcarbamat bei Raumtemperatur – im Fall der Arylbromide – in Gegenwart von Palladiumkatalysatoren wurde erstmals von John F. Hartwig im Jahr 1999 berichtet.[7] Das Arylhalogenid wird mit tert-Butylcarbamat in Toluol, mit Natriumphenolat als Base, dem Liganden Tri-tert-butylphosphin (t-Bu3P) und dem Palladiumkatalysator Bis(dibenzylidenaceton)palladium(0) (Pd(dba)2) umgesetzt.

Dabei werden Ausbeuten von 60 bis 80 % an Carbamaten erreicht.
Diese inzwischen als Buchwald-Hartwig-Kupplung bekannte Reaktion wurde durch Verwendung des Pd(dba)2-Komplexes mit Chloroform als Katalysator, dem Phosphinliganden tert-butyl XPhos und der Base Natrium-tert-butanolat so weit optimiert, dass bereits bei Raumtemperatur brauchbare bis gute Ausbeuten erzielt werden.[13]
Die Amidierung von halogenierten Aromaten und Heteroaromaten mit tert-Butylcarbamat gelingt im System Caesiumcarbonat, 1,4-Dioxan, Palladium(II)-acetat und dem Liganden XPhos (Dicyclohexyl(2',4',6'-triisopropylbiphenyl-2-yl)phosphan) bei 100 °C in oft exzellenten Ausbeuten (> 90 %).[14]
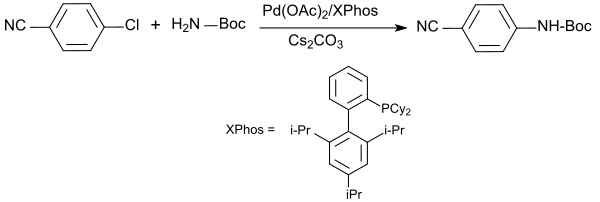
Die besten Resultate werden mit Bromarylen erzielt, aber auch Chloraryle liefern bei deutlich längeren Reaktionsdauern brauchbare Ausbeuten.
Interessanterweise lässt sich diese Reaktion auch in micellaren Lösungen bei Raumtemperatur (bis maximal 50 °C) mit vollständigen Umsätzen und guten Reinausbeuten durchführen.[15]
Mit dem nanomizellenbildenden Tensid TPGS-750-M[16] dem Pd-Katalysator Allylpalladium(II)-chlorid dimer und der Base Natrium-tert-butylat in Wasser bei 40 °C wird z. B. bei der Reaktion von 4-Brombenzophenon mit tert-Butylcarbamat das entsprechende Boc-geschützte Amin in 98%iger Ausbeute erhalten (A), während die konventionelle Reaktion im organischen Lösungsmittel Toluol bei 100 °C eine Produktausbeute von 90 % liefert (B).[7]
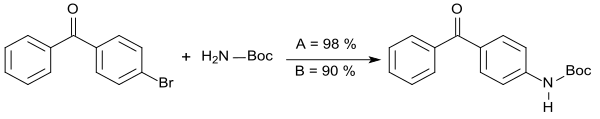
Das wässrige Medium lässt sich mit hoher Effizienz wiedergewinnen und für erneute Umsetzungen verwenden.
Einzelnachweise
- Datenblatt tert-Butyl carbamate bei Sigma-Aldrich, abgerufen am 10. September 2017 (PDF).
- Eintrag zu tert-Butyl Carbamate bei TCI Europe, abgerufen am 10. September 2017.
- B. Loev, M.F. Kormendy, M.M. Goodman: t-Butyl carbamate In: Organic Syntheses. 48, 1968, S. 32, doi:10.15227/orgsyn.048.0032; Coll. Vol. 5, 1973, S. 162 (PDF).
- A. Guingant, S. Collet: tert-Butyl Carbamate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2010, doi:10.1002/047084289X.m01188.
- Y. Tsuzuki, K. Chiba, K. Mizuno, K. Tomita, K. Suzuki: Practical synthesis of (3S,4S)-3-methoxy-4-methylaminopyrrolidine. In: Tetrahedron Asymmetry. Band 12, Nr. 21, 2001, S. 2989–2997, doi:10.1016/S0957-4166(01)00530-4.
- J. Yin, S.L. Buchwald: Palladium-catalyzed intermolecular coupling of aryl halides and amides. In: Org. Lett. Band 2, Nr. 8, 2000, S. 1101–1104, doi:10.1021/ol005654r.
- J.F. Hartwig, M. Kawatsura, S.I. Hauck, K.H. Shaughnessy, L.M. Alcazar-Roman: Room-temperature palladium-catalyzed amination of aryl bromides and chlorides and extended scope of aromatic C-N bond formation with a commercial ligand. In: J. Org. Chem. Band 64, Nr. 15, 1999, S. 5575–5580, doi:10.1021/jo990408i.
- B. Loev, M.F. Kormendy: An improved synthesis of carbamates. In: J. Org. Chem. Band 28, Nr. 12, 1963, S. 3421–3426, doi:10.1021/jo01047a033.
- R. Martin, C.H. Larsen, A. Cuenca, S.L. Buchwald: Cu-catalyzed tandem C-N bond formation for the synthesis of pyrroles and heteroarylpyrroles. In: Org. Lett. Band 9, Nr. 17, 2007, S. 3379–3382, doi:10.1021/ol7014225.
- V. Cadierno, J. Gimeno, N. Nebra: One-pot three-component synthesis of tetrasubstituted N-H pyrroles from secondary propargylic alcohols, 1,3-dicarbonyl compounds and tert-butyl carbamate. In: J. Heterocycl. Chem. Band 47, 2010, S. 233–236, doi:10.1002/jhet.301.
- A. Kuwahara, K. Nakano, K. Nozaki: Double N-arylation of primary amine: Carbazole synthesis from 2,2'-biphenyldiols. In: J. Org. Chem. Band 70, Nr. 2, 2005, S. 413–419, doi:10.1021/jo048472+.
- M.R. Tracey et al.: Science of Synthesis: Houben-Weyl methods of molecular transformation, Vol. 21. Georg Thieme, Stuttgart 2005, ISBN 3-13-118721-2, S. 395.
- S. Bhagwanth, A.G. Waterson, G.M. Adjabeng, K.R. Hornberger: Room-Temperature Pd-Catalyzed Amidation of Aryl Bromides Using tert-Butyl Carbamate. In: J. Org. Chem. Band 74, Nr. 12, 2009, S. 4634–4637, doi:10.1021/jo9004537.
- L. Qin, H. Cui, D. Zou, J. Li, Y. Wu, Z. Zhu, Y. Wu: Pd-catalyzed amidation of aryl(Het) halides with tert-butyl carbamate. In: Tetrahedron Lett. Band 51, Nr. 33, 2010, S. 4445–4448, doi:10.1016/j.tetlet.2010.06.083.
- N.A. Isley, S. Dobarco, B.H. Lipshutz: Installation of protected ammonia equivalents onto aromatic & heteroaromatic rings in water enabled by micellar catalysis. In: Green Chem. Band 16, Nr. 3, 2014, S. 1480–1488, doi:10.1039/C3GC42188K.
- TPGS-750-M: Second-Generation Amphiphile for Organometallic Chemistry in Water at Room Temperature. In: sigmaaldrich.com. Sigma-Aldrich, abgerufen am 15. September 2017 (englisch).