1,2-Dibromethan
1,2-Dibromethan (IUPAC) ist eine farblose giftige Flüssigkeit, die ähnlich wie Chloroform riecht[3] und hauptsächlich als Lösungsmittel, zur Containerbegasung und als Synthese-Zwischenprodukt Verwendung findet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
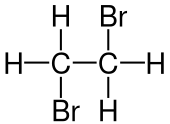 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,2-Dibromethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H4Br2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit süßlichem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 187,86 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
2,18 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
131 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,8 mg·m−3[6] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−79,2 kJ/mol[7] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
1,2-Dibromethan kann durch direkte Bromierung von Ethen (also durch eine klassische Halogen-Additionsreaktion) oder durch Reaktion von Bromwasserstoffsäure mit Ethin hergestellt werden.
Eigenschaften
Dibromethan ist eine nicht brennbare, farblose bis gelbliche Flüssigkeit mit süßlichem, chloroformartigem Geruch.[1][3] Bei Normaldruck siedet die Verbindung bei 131 °C.[1] Die Verdampfungsenthalpie beträgt hier 41,78 kJ·mol−1.[8] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 7,36914, B = 4101,146 und C = 153,034 im Temperaturbereich von 246 K bis 405 K.[9] Dämpfe von Dibromethan sind 6,5 mal so schwer wie Luft. In fester Phase können zwei polymorphe Kristallformen vorliegen. Der Umwandlungspunkt der Tieftemperaturform II zur Hochtemperaturform I liegt bei −23 °C.[10][11] Die Umwandlungsenthalpie dieses Festphasenübergangs beträgt 1,94 kJ·mol−1.[11] Beide Formen stehen enantiotrop zueinander. Die Kristallform I zeigt bei 10 °C einen Schmelzpunkt mit einer Schmelzenthalpie von 10,94 kJ·mol−1.[11] Der Tripelpunkt liegt bei 10 °C.[11] und 9,2 mbar[12] Dibromethan zersetzt sich langsam im Sonnenlicht, ansonsten ist die Verbindung stabil.
Verwendung
Die noch in den 1980er Jahren übliche Verwendung von 1,2-Dibromethan als Zusatz in verbleitem Treibstoff als Radikalfänger (engl. Scavenger) zur Vermeidung von Bleirückständen im Motor wurde wegen seiner Giftigkeit in den Industrieländern eingestellt.[2] Auch die Anwendung als Insektenbegasungsmittel wurde schon in den 1980er Jahren verboten.[2] In der organischen Chemie dient es als Ausgangsstoff für die Herstellung von Arzneistoffen (z. B. Tetramisol und Theodrenalin), Herbiziden (z. B. Diquatdibromid) und Farbstoffen, wo eine Ethylenbrücke in ein Molekül eingeführt werden soll.[2]
Sicherheitshinweise
1,2-Dibromethan verursacht starke Haut- und Schleimhautreizungen und wird durch die Haut resorbiert. Es ruft Kopfschmerzen, Erbrechen, Harnvergiftung, Leber- und Nierenschäden hervor. Außerdem ist es im Tierversuch ein Karzinogen, das für den Menschen ein zu beachtendes Risiko darstellt und der MAK-Gruppe III A 2 zugeordnet wurde.[3]
Weblinks
- Environmental Health Criteria (EHC) für 1,2-Dibomoethame
Einzelnachweise
- Eintrag zu 1,2-Dibromethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- D. Yoffe, R. Frim, S. D. Ukeles, M. J. Dagani, H. J. Barda, T. J. Benya, D. C. Sanders: Bromine Compounds. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH, Weinheim 2013, doi:10.1002/14356007.a04_405.pub2.
- Eintrag zu 1,2-Dibromethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- Datenblatt 1,2-Dibromethan bei Sigma-Aldrich, abgerufen am 5. März 2011 (PDF).
- Eintrag zu 1,2-dibromoethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 106-93-4 bzw. 1,2-Dibromethan), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- V. Svoboda, V. Kubes, P. Basarova: Enthalpies of vaporization and cohesive energies of 1,1,2,2-tetrachloro-1,2-difluoroethane, 1,2-dibromoethane, 1-bromo-2-chloroethane, 1,3-dibromo-propane, and 1,4-dibromo-2,3-dichloro-1,1,2,3,4,4-hexafluorobutane. In: J. Chem. Thermodyn. 24, 1992, S. 555–558. doi:10.1016/S0021-9614(05)80125-9
- D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. 39, 1947, S. 517–540, doi:10.1021/ie50448a022.
- W. E. Railing: The specific heat of some ethylene halides. In: J. Am. Chem. Soc. 61, 1939, S. 3349–3353. doi:10.1021/ja01267a034
- K. S. Pitzer: The heat capacities, heats of transition and fusion, and entropies of ethylene dichloride and ethylene dibromide. In: J. Am. Chem. Soc. 62, 1940, S. 331–335. doi:10.1021/ja01859a028
- berechnet aus Dampfdruckfunktion


