Pivaloylchlorid
Pivaloylchlorid ist eine chemische Verbindung aus der Gruppe der Carbonsäurechloride.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
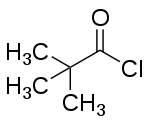 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pivaloylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H9ClO | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 120,58 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,979 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
105–106 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,412 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Pivaloylchlorid kann durch verschiedene Synthesen gewonnen werden. So zum Beispiel durch das von Butlerow[5] beschriebenen Verfahren, das in der Umsetzung von Pivalinsäure mit Phosphorpentachlorid nach der Reaktion besteht:[6]
Da das Phosphoroxychlorid und das erhaltene Pivaloylchlorid Siedetemperaturen haben, die so nahe beieinander liegen (104–106 °C), dass es praktisch unmöglich ist, sie zu trennen, wurden Verbesserungen gesucht. Butlerow hat dem erhaltenen Reaktionsgemisch auch Kaliumpivalat zugesetzt, um Phosphoroxychlorid nach der Reaktion zu Phosphorpentoxid umzuwandeln:[6]
Andere Autoren (Bull. Soc. Chim. Fr., S. 350–351, 1939) haben in Anlehnung an dieses Verfahren vorgeschlagen, Pivaloylchlorid direkt in einer einzigen Reaktion von Natriumpivalat mit Phosphoroxychlorid gemäß der Reaktion herzustellen:[6]
Bei einem 25%igen molaren Überschuss an Natriumpivalat beträgt die molare Ausbeute an Pivaloylchlorid nur 81 % bezogen auf das eingesetzte Phosphoroxychlorid, was natürlich einen industriellen Prozess ausschließt, zumal der Preis für Natriumpivalat deutlich höher ist als der Preis für das gewünschte Pivaloylchlorid.[6]
Es wurde der Vorschlag gemacht, anstelle von Phosphorpentachlorid Phosphortrichlorid zu verwenden[7], und zwar nach der Reaktion:[6]
Die gebildete Salzsäure wird kontinuierlich entfernt und das Pivaloylchlorid nach Abtrennung durch Absetzen der wertmäßig zurückgewinnbaren phosphorige Säure destillativ gereinigt. Die molare Ausbeute an Pivaloylchlorid liegt jedoch unter 90 %, bezogen auf die eingesetzte Pivalinsäure, und es ist sehr schwierig, die letzten Spuren der phosphorigen Säure (Reduktionsprodukt) zu entfernen, was die Verwendung von Pivaloylchlorid in bestimmten Synthesen ausschließt.[6]
Eines der in der Literatur am häufigsten erwähnten Verfahren zur Synthese von Pivaloylchlorid ist die Verwendung von Thionylchlorid nach der Reaktion:[6]
Die Reaktion wird im Allgemeinen in Gegenwart eines 20- bis 50-prozentigen molaren Überschusses an Thionylchlorid durchgeführt.[6]
Unter diesen Bedingungen entstehen molare Ausbeuten an destilliertem Pivaloylchlorid, die nahe bei 90 % liegen. Die Zugabe von Katalysatoren, wie DMF, Pyridin oder N-Methylacetamid, ermöglicht es, die Reaktionskinetik zu erhöhen und die Selektivität zu verbessern (Rückgang des Anteils an Nebenprodukten, wie z. B. des Anhydrids).[6]
Dieses Verfahren hat jedoch den Nachteil, dass ein Pivaloylchlorid entsteht, das Schwefel enthalten kann. Außerdem ist der Katalysator im Falle der Verwendung eines Katalysators schwer zu recyceln.[6]
Pivaloylchlorid kann auch aus Phosgen nach der folgenden Reaktion gewonnen werden:[6]
oder alternativ durch Carbonylierung von tert-Butylchlorid in Gegenwart von Katalysatoren, wie Aluminiumchlorid oder Eisen(III)-chlorid, nach der Reaktion:[6]
Eigenschaften
Pivaloylchlorid ist eine farblose Flüssigkeit mit stechendem Geruch, die sich in Wasser und bei Erhitzung zersetzt.[1]
Verwendung
Pivaloylchlorid wird als weit verbreitetes N-Acylierungsmittel für Amine, Schiffsche Basen und Pyrrolidinone sowie O-Acylierungsmittel für Alkohole, Lactone und Saccharide verwendet.[3]
Einzelnachweise
- Eintrag zu Pivaloylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- G. W. A. Milne: Gardner's Commercially Important Chemicals Synonyms, Trade Names, and Properties. John Wiley & Sons, 2005, ISBN 0-471-73661-9, S. 502 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Trimethylacetyl chloride, 99% bei Sigma-Aldrich, abgerufen am 20. Dezember 2020 (PDF).
- Datenblatt Pivalinsäurechlorid (PDF) bei Merck, abgerufen am 20. Dezember 2020.
- Justus Liebigs Ann. Chem., S. 373, 1874
- Google Patents: US6605743B1 – Continuous process for the preparation of pivaloyl chloride and of aroyl chloride, abgerufen am 20. Dezember 2020.
- J. Am. Chem. Soc., 54, S. 3438–3441, 1932


