Phosphorpentafluorid
Phosphorpentafluorid (Phosphor(V)-fluorid) ist eine anorganische, chemische Verbindung aus den Elementen Phosphor und Fluor mit der Summenformel PF5 und zählt zur Verbindungsklasse der Phosphorhalogenide. Es ist bei Standardbedingungen ein farbloses, sehr giftiges und nicht brennbares Gas mit stechendem Geruch. In feuchter Luft oder in Wasser gelöst reagiert es heftig unter Bildung von Fluorwasserstoff HF und Phosphorsäure H3PO4.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
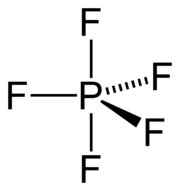 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phosphorpentafluorid | ||||||||||||||||||
| Andere Namen |
Phosphor(V)-fluorid | ||||||||||||||||||
| Summenformel | PF5 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem Geruch, schwerer als Luft[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 125,97 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
5,69 kg·m−3 bei 0 °C, 1013 mbar[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−84,6 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Phosphorpentafluorid wurde 1876 von dem britischen Chemiker Thomas Edward Thorpe (1845–1925) entdeckt und erstmals beschrieben.[2]
Gewinnung und Darstellung
Phosphorpentafluorid kann durch Fluorierung von Phosphorpentachlorid PCl5 mit Hilfe von Arsentrifluorid AsF3 unter Bildung von Arsentrichlorid AsCl3 dargestellt werden.
Das Phosphorpentafluorid entweicht dabei als stark rauchendes Gas, während das Arsentrichlorid zurückbleibt.
Eigenschaften
Physikalische Eigenschaften
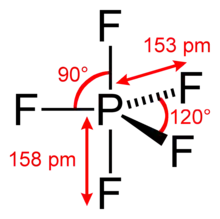
Phosphorpentafluorid-Moleküle sind trigonal-bipyramidal aufgebaut, mit dem Phosphoratom im Zentrum und den kovalent gebundenen Fluoratomen in der dreieckigen Grundfläche (äquatoriale Positionen) und an den beiden Spitzen (axiale oder apikale Positionen) der Bipyramide. Die F−P–F-Bindungswinkel in der Grundfläche betragen 120°, während die Bindungen zu beiden apikalen Fluoratomen senkrecht zur Grundfläche stehen. Die Bindungslängen zwischen Phosphor und den äquatorialen Fluoratomen betragen jeweils 153 pm und sind um 5 pm kürzer als zu den beiden Atomen in apikaler Position (158 pm).
Obwohl durch die Geometrie der trigonalen Bipyramide zwei Arten von Fluoratomen sich unterscheiden müssten, erhält man bei Messungen mit der 19F-NMR-Spektroskopie anstatt der erwarteten zwei nur ein einziges Signal für die Fluoratome. Dies wird durch die Berry-Pseudorotation verursacht, bei der die Fluoratome ständig ihre Positionen innerhalb des Moleküls wechseln. Dieser Wechsel vollzieht sich schneller als das Messgerät ihn erfassen kann und eine zeitlich gemittelte Struktur mit scheinbar fünf gleichwertigen Fluoratomen wird in den Spektren wiedergegeben.
Bei Standardbedingungen ist Phosphorpentafluorid ein farbloses Gas und ca. 4,5 mal so schwer wie Luft.
Unterhalb des Schmelzpunkts von −93,8 °C kristallisiert Phosphorpentafluorid im hexagonalen Kristallsystem in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 556 pm und c = 618 pm (c/a = 1,11) sowie zwei Formeleinheiten pro Elementarzelle.[3]
Chemische Eigenschaften
Phosphorpentafluorid ist extrem anfällig gegenüber Hydrolyse. In feuchter Luft oder allgemein bei Kontakt mit Wasser zersetzt es sich spontan in einer heftigen Reaktion unter Bildung von Fluorwasserstoff HF und Phosphorsäure H3PO4.
In Lösungen mit hohen Fluoridionen-Konzentrationen reagiert Phosphorpentafluorid als Lewis-Säure zum Hexafluorophosphat(V)-Anion PF6−, das isoelektronisch zum Schwefelhexafluorid SF6 und Hexafluorosilicat(IV)-Anion SiF62− ist. Die zu Grunde liegende Hexafluorophosphorsäure HPF6 lässt sich, analog der Hexafluorokieselsäure H2SiF6, nicht durch Entwässerung in reiner Form isolieren, sondern zerfällt unter Abspaltung von HF wiederum zu PF5.
Durch die Abspaltung von HF bei Kontakt mit Wasser ätzt Phosphorpentafluorid Glasoberflächen.
Von Phosphorpentafluorid existieren Derivate in Form der Fluorophosphane HPF4, H2PF3 und H3PF2, wobei die Wasserstoffatome Fluoratome in äquatorialen Positionen ersetzen.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 780.
- T. E. Thorpe: Ueber Phosphorpentafluorid. In: Justus Liebigs Annalen der Chemie. Bd. 182, Nr. 1–2, 1876, S. 201–206. ISSN 0075-4617
Weblinks
Einzelnachweise
- Eintrag zu Phosphorpentafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- T. E. Thorpe: On Phosphorus Pentafluoride. In: Proceedings of the Royal Society of London. Bd. 25, 1876, S. 122–123.
- D. Mootz, M. Wiebcke: Fluorides and fluoro acids. XIII. The crystal structure of phosphorus pentafluoride. In: Zeitschrift für Anorganische und Allgemeine Chemie. Bd. 545, Nr. 2, 1987, S. 39–42. doi:10.1002/zaac.19875450204.


