Tetraphosphorhexafluorid
Tetraphosphorhexafluorid ist eine chemische Verbindung des Phosphors aus der Gruppe der Fluoride.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
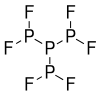 | |||||||
| Allgemeines | |||||||
| Name | Tetraphosphorhexafluorid | ||||||
| Summenformel | P4F6 | ||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 237,89 g·mol−1 | ||||||
| Aggregatzustand |
gasförmig[1] | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Tetraphosphorhexafluorid entsteht neben Phosphortrifluorid und weiteren Zersetzungsprodukten beim Erhitzen von Diphosphortetrafluorid auf 900 °C.[1][3]
Eigenschaften und Darstellung
Tetraphosphorhexafluorid ist ein farbloses Gas mit einer P(PF2)3-Struktur.[1] Unter −68° C liegt es als Feststoff vor. Bei Temperaturen über −68° C ist es eine zähflüssige, ölige, klare Flüssigkeit. Es kann jedoch durch teilweise Zersetzung eine schwarze oder orange-gelbe Färbung aufweisen. In der Flüssigphase ist es bis etwa 0 °C recht stabil. Oberhalb von 0 °C zersetzt sich die Verbindung in der Flüssigphase schnell zu Phosphortrifluorid und Phosphorfluoridpolymeren. In der Gasphase zersetzt es sich bei Drücken über 10 Millitorr bei allen Temperaturen leicht. Die Zersetzung in der Gasphase wird durch die Anwesenheit von Fetten katalysiert.[4]
An der Luft raucht die Verbindung, entzündet sich aber bei ihrer Oxidation nicht spontan. Sie zersetzt sich vollständig in Natriumperoxidlösung. In Acetonitril gelöst und auf Raumtemperatur erwärmt, zersetzt sie sich zu Phosphortrifluorid und Phosphorfluoridpolymeren. Eine Lösung von Tetraphosphorhexafluorid in Schwefelkohlenstoff erweist sich jedoch bei Raumtemperatur als völlig stabil. Wenn eine Lösung der Verbindung in Schwefelkohlenstoff mit Luft in Kontakt gebracht wurde, entstehen weiße Dämpfe und das Tetraphosphorhexafluorid zersetzt sich rasch zu Phosphorfluoridpolymeren oder Phosphoroxiden. Eine solche Lösung könnte als Initiator oder Katalysator für einen radikalischen Kettenmechanismus oder Polymerisationsprozess oder als Herbizid verwendet werden. Die Lösung könnte auch als Sauerstoff-Getter für Reaktionen in Schwefelkohlenstoff verwendet werden.[4]
Einzelnachweise
- Eintrag zu Phosphorfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Dezember 2021.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- D. Solan, P. L. Timms: The thermal dissociation of diphosphoros tetrafluoride and the formation of tetraphosphorus hexafluoride. In: Chemical Communications (London). Nr. 23, 1968, S. 1540–1541, doi:10.1039/C19680001540.
- Patent US3607052A: Tetraphosphorus Hexafluoride and method for production and stabilization therof. Angemeldet am 16. Juni 1969, veröffentlicht am 21. September 1971, Anmelder: US Army, Erfinder: David Solan.