Kleiner Schwertwal
Der Kleine Schwertwal (Pseudorca crassidens), auch bekannt als Unechter oder Schwarzer Schwertwal, ist eine Art der Delfine (Delphinidae) und der einzige rezente Vertreter der Gattung Pseudorca. Er ähnelt dem Orca in Form und Proportionen, ist aber einfarbig schwarz und mit einer Maximallänge von etwa sechs Metern deutlich kleiner. Kleine Schwertwale bilden Schulen von durchschnittlich zehn bis fünfzig Tieren, wobei sie sich auch mit anderen Delfinen vergesellschaften und sich meistens abseits der Küsten aufhalten. Sie sind in allen Ozeanen gemäßigter, subtropischer und tropischer Breiten beheimatet, sind jedoch vor allem in wärmeren Jahreszeiten auch bis in die gemäßigte bis subpolare Zone südlich der Südspitze Südamerikas, vor Nordeuropa und bis vor Kanada anzutreffen.
| Kleiner Schwertwal | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Kleiner Schwertwal | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Pseudorca | ||||||||||||
| Reinhardt, 1862 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Pseudorca crassidens | ||||||||||||
| (Owen, 1846) |
Wie andere Delfine ist der Kleine Schwertwal ein aktiver Jäger und ernährt sich vor allem von größeren Fischen und Kopffüßern, kann jedoch vereinzelt auch kleinere Delfine oder auch Großwale attackieren. Im Vergleich zum Großen Schwertwal (Orcinus orca) sowie einigen anderen Delfinarten ist er nur wenig erforscht und Sichtungen sind vergleichsweise selten. Strandungen kommen vor, teilweise auch als Massenstrandungen mit mehreren Hundert Tieren, sind jedoch weniger häufig als bei den bekannteren Arten.
Merkmale
Allgemeine Merkmale

Der Kleine Schwertwal ist, abseits vom Großen Schwertwal, eine der größten Arten innerhalb der Delfine. Die Männchen des Kleinen Schwertwals erreichen Körperlängen von bis zu 6,10 Metern und ein Maximalgewicht von 2200 Kilogramm, die Weibchen bleiben mit maximal 5,10 Metern und einem Gewicht von maximal 1200 Kilogramm deutlich kleiner.[1] Die neugeborenen Jungtiere haben eine Länge von 1,5 bis 2,0 Metern und wiegen etwa 80 Kilogramm.[1] Der Körper der Tiere ist auf der Rückenseite und den Flanken sowie am Bauch vollständig dunkelgrau bis schwarz gefärbt und auch die Rückenflossen, die Flipper und die Schwanzflosse (Fluke) entsprechen der Körperfärbung.[2] Bei guten Lichtverhältnissen ist erkennbar, dass der Rücken von der Rückenflosse nach hinten umhangartig dunkler gefärbt ist als davor,[3] die dunkelste Pigmentierung befindet sich dabei im Bereich des Ansatzes der Fluke.[2] Zwischen den Brustflossen befindet sich häufig ein gräulicher bis fast weißer ankerförmiger Fleck, der bei manchen Individuen an der Kehle beginnen und in eine Linie auslaufen kann, die sich bis zum Genital zieht.[1] In einigen Fällen besitzen die Tiere zusätzlich einen hellen grauen Fleck an den Kopfseiten.[2] Die typische dunkle Färbung ist bereits bei den Jungtieren vorhanden und konnte auch vorgeburtlich bei einem etwa 70 Zentimeter langen Embryo nachgewiesen werden.[2] Narben aus innerartlichen und externen Interaktionen bilden, anders als etwa bei dem nahe verwandten Rundkopfdelfin (Grampus griseus), neue Pigmente aus und werden damit erneut schwarz;[4] der Körper kann jedoch lokal sternförmige Narben verheilter Bisse von Zigarrenhaien (Isistius) aufweisen.[2]
Der Körper der Wale ist relativ schlank und der Kopf im Verhältnis zur Gesamtlänge nur kurz. Die Stirnpartie (Melone) ist langgezogen und ein wenig vorgewölbt; einen abgesetzten Schnabel gibt es nicht. Bei den ausgewachsenen Männchen ist die Melone weiter vorgewölbt als bei den Weibchen und bei den jugendlichen Walen.[3] Der Bereich um das Blasloch ist ein wenig eingewölbt. Etwa in der Mitte des Körpers befindet sich die sichelförmige Rückenflosse; die relativ kurzen Brustflossen (Flipper) setzen weit vorne am Körper an und haben eine arttypische Form mit vorderem S-förmigen Rand und einer spitz zulaufenden, abgerundeten Flossenspitze. Die Schwanzflosse (Fluke) ist ebenfalls kurz; die Einbuchtung in der Mitte ist nicht sehr ausgeprägt.[1]
Merkmale des Schädels und des Skeletts
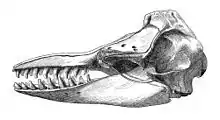
Der Schädel des Kleinen Schwertwals ist kräftig mit einer kurzen und breiten Schnauzenregion. Diese ist mindestens 1,5 Mal so lang wie breit und verbreitert sich mit dem Alter der Tiere. Die Gesamtlänge des Schädels eines ausgewachsenen Tieres beträgt etwas mehr als 50 Zentimeter. Der Wal hat sehr kräftige, konisch geformte und gebogene Zähne. Im Oberkiefer sitzen sieben bis elf, im Unterkiefer acht bis zwölf Zähne pro Kieferhälfte,[2] wobei bei sehr vielen Tieren die Anzahl der Zähne im rechten Unter- und Oberkiefer nicht der im linken entspricht (bilaterale Asymmetrie). Die gleichförmige oder homodonte Bezahnung dieser Art, bei der es keine unterschiedlichen Zahntypen wie bei anderen Säugetieren gibt, ist typisch für die gesamte Unterordnung der Zahnwale und stellt eine Anpassung an ihre bevorzugte Nahrung aus schwierig zu fixierenden, stromlinienförmigen und glatten Beutetieren wie Fischen und Kopffüßern dar.
Vom Schädel des Großen Schwertwals lässt sich der des Kleinen Schwertwals durch die Proportionen der Knochen zueinander unterscheiden: Beim Großen Schwertwal entspricht die Breite des Zwischenkieferbeins (Prämaxillare) direkt vor den antorbitalen Kerben, also den Kerben vor den Augen, mehr als 50 % der Gesamtbreite des Gesichtsschädels, beim Kleinen Schwertwal weniger als 50 %. Zudem ist der Seitenrand der Zwischenkieferbeine in der Aufsicht bei letzterem stärker S-förmig geformt und im vorderen Bereich breiter.[2] Die Paukenhöhlen erreichen eine Länge von 47,7 bis 50,5 Millimeter, sie besitzen einen atrophierten Kiel und sind nicht seitlich abgeflacht.[2]
Die Wirbelsäule besteht aus 7 Halswirbeln, 9 bis 11 Brustwirbeln, 9 bis 13 Lendenwirbeln und 16 bis 26 Schwanzwirbeln, dabei liegt die Gesamtzahl der Wirbel bei 47 bis 52. Bei zahlreichen Tieren sind vor allem die ersten vier bis sieben Schwanzwirbel zudem in unterschiedlicher Anzahl miteinander verwachsen, wobei die Anzahl verwachsener Wirbel wahrscheinlich mit dem Alter steigt.[2] Der Brustkorb besteht aus 9 bis 12, meist 10 Rippenpaaren, von denen 6 jeweils zwei Ursprünge haben (bicipital). Die Anzahl der Rippen pro Körperseite kann unterschiedlich sein. Vier Rippenpaare sind direkt mit dem Brustbein verwachsen, sechs weitere über Knorpel mit diesem verbunden. Das 11. und 12. Rippenpaar sind, wenn vorhanden, nicht mit dem Brustbein verbunden und entsprechend frei endend. Das Brustbein selbst besteht aus vier Teilen, die mit dem Alter zunehmend verwachsen.[2] Die Anzahl der Fingerknochen der Flipper kann stark variieren, in der Regel haben die Tiere null bis einen Knochen am ersten, vier bis acht Knochen am zweiten, vier bis sechs Knochen am dritten, einen bis drei Knochen am vierten und null bis zwei Knochen am fünften Finger. Wie bei allen Walen sind die Finger über das umgebende Gewebe zu einer Flosse (Flipper) verbunden.[2]
Genetische Merkmale
Wie andere Wale weist auch der Kleine Schwertwal den für diese Tiergruppe typischen Chromosomensatz von 2n = 44 Chromosomen auf. Dabei wird der Kleine Schwertwal als karyotypisch stabiler eingeschätzt als der Große Schwertwal. In der Gefangenschaft kam es wiederholt zu Hybridisierungen mit dem Großen Tümmler, da die Genome dieser beiden Arten kompatibel sind.[5]
Verbreitung
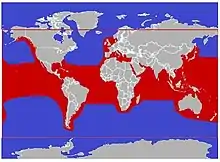
Der Kleine Schwertwal ist eine Hochseeart, die in den gemäßigten bis tropischen Bereichen aller Ozeane anzutreffen ist.[1][6] Dabei sind Sichtungen abseits der Küsten relativ selten, und auch Strandungen kommen nur gelegentlich vor. Häufig beobachtet wurde der Wal im Atlantik vor der nordamerikanischen Küste und in der Karibik. Auch im Pazifik und im Indischen Ozean kommt er regelmäßig vor. Zum Verbreitungsgebiet gehören zudem einzelne abgegrenzte Meeresregionen wie das Mittelmeer, der Golf von Mexiko, der Golf von Kalifornien, das Rote Meer und das Arabische Meer sowie das Japanische Meer.[1][7] Im Bereich tropischer Inseln, vor allem um Hawaii, kommen die Tiere auch küstennah vor.[8] Wahrscheinlich führen die Tiere saisonale Wanderungen durch und kommen vor allem im Winter in flachere Gewässer in Küstennähe.[9]
Der Verbreitungsschwerpunkt liegt zwischen dem 40. nördlichen und dem 40. südlichen Breitengrad.[7] Die Tiere wurden in Gewässerbereichen mit einer Temperatur zwischen 8 und 31 °Celsius nachgewiesen,[10] wobei sie höhere Wassertemperaturen bevorzugen.[9] Die bislang südlichste Verbreitung der Tiere ist durch eine Gruppe Kleiner Schwertwale aus der Region östlich des südlichsten Punktes des südamerikanischen Kontinents am Kap Hoorn, Chile belegt. Durch diese Sichtung wurde zudem nachgewiesen, dass die Tiere zumindest temporär in Kaltwassergebieten bis 8 °Celsius leben können.[10] Durch eine Massenstrandung von 22 Kleinen Schwertwalen an der Ostküste der Falklandinseln im Jahr 2013 wurde die Art auch für diese Region erstmals nachgewiesen.[11]
Die europäischen Nachweise der Art stammen meist aus Sichtungen einzelner Gruppen der Wale sowie aus Berichten über Strandungen. Sie wurden an den Küsten Großbritanniens, Spaniens, der Niederlande und der deutschen und dänischen Nordseeküste gemacht. Außerdem gibt es seltene Sichtungen in der Ostsee sowie im Mittelmeer, hier vor allem aus Südspanien und Italien. Die nördlichsten Nachweise in Nordamerika stammen aus Kanada, wo im Mai 1987 ein Individuum auf Denman Island, British Columbia, strandete.[12]
Lebensweise
_(http-www.bluekaymahahual.com)_-_panoramio.jpg.webp)
.jpg.webp)
Der Kleine Schwertwal ist eine Walart, die die tiefen Bereiche der Ozeane, also das Pelagial, als Lebensraum bevorzugt. Entsprechend sind diese Wale vor allem in der Hochsee zu beobachten, aber auch in der Nähe von Inseln und Küsten, die von tiefem Wasser umgeben sind. Aufgrund der küstenfernen Verbreitung und des Lebens im Hochseebereich ist die Lebensweise der Kleinen Schwertwale nur unzureichend erforscht. Die meisten Informationen über die Art stammen aus Untersuchungen gestrandeter Tiere, in Gefangenschaft lebender Tiere und aus Sichtungen vor allem in Küstennähe, etwa um Hawaii und andere Inseln.[3]
Die Tiere sind tagsüber und nachts aktiv,[3] wobei sie wahrscheinlich ihre maximale Aktivität tagsüber haben.[1] Die Wale leben in Schulen mit einer durchschnittlichen Größe von 5 bis 25 Individuen,[3] wobei gelegentlich auch größere Gruppen von über 100 bis 400 Tieren beobachtet wurden. Die Gruppen schwimmen dabei teilweise weit auseinander mit Geschwindigkeiten von 5 bis 20 Kilometern pro Stunde, und eine Schule kann sich über eine Länge von bis 20 Kilometern hinziehen.[3] Dabei springen die Tiere regelmäßig vollständig aus dem Wasser.[9] Innerhalb der Schulen haben Kleine Schwertwale starke soziale Bindungen der Einzeltiere untereinander, wobei die Individuen teilweise jahrelang zusammenbleiben. Diese kleineren, stabileren Gruppen sind alters- und geschlechtsgemischt, und es scheint keine offensichtliche Geschlechts- oder Alterstrennung bei dieser Art zu geben.[3] Größere Gruppen sind häufig Zusammenschlüsse mehrerer kleiner Schulen, die sich in der Regel nach einiger Zeit wieder voneinander trennen.[3] Die bislang größte dokumentierte gestrandete Gruppe der Wale bestand aus 835 Individuen in Mar del Plata (Argentinien) im Jahr 1946.[3]
Es kommt vor, dass sich die Schulen mit anderen Walen, hauptsächlich mit Schulen des Großen Tümmlers (Tursiops truncatus) und des Rauzahndelfins (Steno bredanensis) zusammenschließen und Jagdgemeinschaften bilden.[13][8][3] Vor allem die Beziehungen zu den Tümmlern kann dabei über mehrere Jahre bestehen, wie bei Langzeitstudien um Neuseeland festgestellt wurde.[13][3] Die Gruppen bestehen aus Tieren verschiedenen Alters, deren Sozialgefüge sehr ausgeprägt ist. In den Gebieten um Hawaii wurden langfristige Beziehungen innerhalb der Schulen von bis zu 15 Jahren nachgewiesen,[14][4] Massenstrandungen dieser Tiere werden auf diese engen individuellen Bindungen zurückgeführt.[4] Über das Tauchverhalten dieser Art ist wenig bekannt; ein markiertes Tier tauchte bis zu 12 Minuten lang und in Tiefen von über 230 Metern.[4]
Zur innerartlichen Kommunikation sowie zur Sonarorientierung und zum Beutefang besitzt der Kleine Schwertwal ein vielfältiges Repertoire an Tönen. Dabei nutzen sie vor allem langgezogene Rufe in einer Frequenz von 28 kHz, die etwa 60 bis 75 Millisekunden andauern und ein wellenförmiges Frequenzbild ähnlich dem der Tümmler aufweisen. Hinzu kommen längere Klicksequenzen, einzelne oder doppelte Klicklaute mit einer Frequenz von etwa 100 kHz und kurze Pfiffe in einer Frequenz von etwa 8 kHz.[9] Anhand von Unterwassersonagrammen wurde abgeschätzt, dass die Hörspanne der Tiere von 2 bis 115 kHz mit einem Höroptimum zwischen 32 und 70 kHz reicht.[9]
Ernährung
Der Kleine Schwertwal ernährt sich wie andere Delfine vor allem von verschiedenen Fischen und Kopffüßern. Die Zusammensetzung der Nahrung kann regional aufgrund der verfügbaren Beutetiere sehr unterschiedlich sein. Es wird angenommen, dass die Tiere täglich etwa 4,7 bis 5 % ihres Gewichts an Nahrung zu sich nehmen, wobei die Kalkulation auf Tiere in Gefangenschaft bezogen ist.[9] Die Jagd und Nahrungsaufnahme erfolgt unabhängig von der Tageszeit sowohl tagsüber wie nachts; auf der Basis von Magenanalysen gestrandeter Tiere wurde eine höhere Nahrungsmenge im Winter als in den anderen Jahreszeiten angegeben.[9] Die Tiere jagen gemeinsam in Schulen und teilen die Beute untereinander auf.[3]
Zu den Beutetieren gehören unter anderem verschiedene pelagisch lebende Tintenfische und Kalmare wie Martialia hyadesi, Ilex argentinus, Berryteuthis magister, Gonatopsis borealis und Ommastrephes bartramii[15], des Weiteren verschiedene Fische wie Meereslachse (Oncorhynchus), Bonitos (Katsuwonus pelamis), Große Goldmakrelen (Coryphaena hippurus) und andere Makrelen, Mondbarsche (Mene maculata), Japanische Meerbarsche (Lateolabrax), Thunfische (Thunnus) und Fächerfische (Istiophorus platypterus).[1][9] Einige der Beutetiere, vor allem die Thunfische und Fächerfische, sind dabei ziemlich groß, und besonders in der Region um Japan ist der Kleine Schwertwal dafür bekannt, Thunfische von den Fischfangleinen zu fressen. Auch in anderen Regionen, etwa um Hawaii und im Golf von Mexiko und im Indischen Ozean, sind Kleine Schwertwale eine von wenigen Arten der Zahnwale, die gelegentlich Fische sowohl von kommerziellen Fischern als auch von Freizeitfischern stehlen.[4]
Zudem wurden Kleine Schwertwale dabei beobachtet, dass sie auch kleinere und junge Delfine attackieren und sich von diesen ernähren. Dieses Verhalten wurde bislang nur regional begrenzt im Bereich der Thunfischfangzonen im Pazifik beobachtet, in denen verletzte Delfine von den Fangleinen befreit und freigelassen wurden. Es wird daher nur vereinzelten Populationen mit einer bestimmten Anpassung an diese zusätzliche Nahrungsquelle zugeschrieben.[3] In seltenen Fällen wurde auch beobachtet, dass Kleine Schwertwale in Schulen Buckelwale (Megaptera novaeangliae) und in der Region um die Galápagos-Inseln auch Pottwale (Physeter macrocephalus) attackierten.[16][1][4]
Fortpflanzung und Entwicklung
Angaben und Daten über die Entwicklung der Tiere stammen fast ausschließlich aus Untersuchungen von gestrandeten Individuen und beziehen sich häufig auf Zahnuntersuchungen, um das Alter der gestrandeten Tiere anhand der Schmelzschichten festzustellen. Über das Alter der Geschlechtsreife und andere altersbezogene Daten gibt es entsprechend unterschiedliche Angaben. Bei beiden Geschlechtern wird angenommen, dass sie im Alter von 8 bis 14 Jahren geschlechtsreif werden, wobei vermutet wird, dass die Männchen erst später paarungsfähig werden.[4] Für die Meeresgebiete vor Japan wird angenommen, dass die Weibchen die Geschlechtsreife mit einer Länge von 3,40 bis 3,80 Metern und somit in einem Alter von 8 bis 11 Jahren erreichen; bei den Männchen soll die Geschlechtsreife allerdings erst bei einer Länge von mehr als 4,20 Metern und einem Alter von etwa 18 Jahren eintreten.[17] Demgegenüber gibt es Schätzungen, nach denen auch die Männchen bereits mit 8 bis 14 Jahren geschlechtsreif sein sollen.[17] Im Gegensatz zu den Weibchen, bei denen die Geschlechtsreife mit der ersten Ovulation einhergeht, ist diese bei den Männchen allerdings nur schwer und indirekt feststellbar, etwa über die Größe und das Gewicht der Hoden.[17]
Der Eisprung der Weibchen findet wahrscheinlich einmal im Jahr statt, wobei er spontan stattfindet und keine feste Periodik aufweist. Dabei wird nur eine Eizelle pro Eisprung freigegeben.[17] Die Paarungszeit ist entsprechend ganzjährig, regional kann es aber zu einer umweltbedingten Periodizität kommen. So finden in den Gewässern um Japan die meisten Paarungen im Dezember bis Januar statt. Die Anzahl trächtiger Weibchen innerhalb der Population beträgt nach Abschätzungen etwa 14,5 %.[17] Das Kalbungsintervall, also der Abstand zwischen zwei Geburten einzelner Weibchen wird mit etwa 7 Jahren angegeben, und das Kalben kann das ganze Jahr über erfolgen, mit einem Höhepunkt im Spätwinter.[4] Mit dem Alter der Weibchen nimmt der Abstand zwischen den Kalbungen zu, und man nimmt an, dass Weibchen mit einem Alter über 45 Jahre keine Jungtiere mehr bekommen.[17] Dies konnte unter anderem durch die Untersuchung der Ovarien gestrandeter Wale aus Japan und Südafrika bestätigt werden.[18]
Die Dauer der Schwangerschaft beträgt etwa ein Jahr, und die Weibchen gebären immer nur ein Jungtier.[17] Bei einer Dokumentation 1997 vor der Küste von Marokko konnte die Geburt eines Kleinen Schwertwals beobachtet werden. Diese fand in einer Gruppe von Schwertwalen statt, die sich einem Boot genähert hatte, und das Muttertier befand sich inmitten dieser Gruppe, als das Jungtier geboren wurde. Erkennbar wurde die Geburt anhand eines sich ausbreitenden Blutflecks und eines Stücks Plazenta, das abgetrieben wurde. Direkt nach der Geburt wurde das Neugeborene von den Walen der Gruppe gemeinsam über die Wasseroberfläche gehoben, um die Atmung zu ermöglichen. Danach wurde es wieder ins Wasser herabgelassen, um gemeinsam mit der Gruppe zu schwimmen.[19]
Das Jungtier ist bei der Geburt etwa 1,50 bis 2,0 Meter lang. Die Stillzeit durch die Mutter beträgt danach wahrscheinlich etwa 18 bis 24 Monate.[19] Die maximale Lebensdauer wird mit 57 Jahren für die männlichen Tiere und 62 Jahren für die weiblichen Tiere angenommen.[9][4] Die Generationendauer beträgt schätzungsweise 25 Jahre.[6]
Fressfeinde und Parasiten

Über Fressfeinde beim Kleinen Schwertwal liegen nur wenige Informationen vor, es wird jedoch angenommen, dass einzelne Tiere von großen Haien oder Walen wie dem Großen Schwertwal erbeutet werden.[4] Angriffe von großen Haien sind dabei über typische Narben von Haibissen bei lebenden Individuen dokumentiert.[3] Über einen Angriff einer Schule Großer Schwertwale auf eine gemischte Gruppe Kleiner Schwertwale und Tümmler bei Neuseeland wurde 2010 berichtet. Dabei wurden die Kleinen Schwertwale in der für Große Schwertwale typischen Weise von unten attackiert und aus dem Wasser geschleudert. Mindestens ein Kalb der Kleinen Schwertwale wurde bei dem Angriff getötet und gefressen.[20] Der Zusammenschluss mit anderen Arten ist wahrscheinlich eine Strategie zur Räubervermeidung, wobei die verschiedenen Arten unterschiedlich auf potenzielle Angreifer reagieren.[13]
Zudem werden die Wale wie andere von Zigarrenhaien (Isistius) attackiert, die mit Hilfe ihres speziellen Gebisses in der Lage sind, Stücke aus der Haut der Wale zu reißen und zu fressen. Der Körper der Wale kann entsprechend lokal von frischen Wunden und sternförmigen Narben der verheilten Bisse übersät sein.[2]
Parasiten sind durch Magen- und Darmuntersuchungen gestrandeter Tiere dokumentiert. So wurde etwa bei Strandungen in Brasilien eine hohe Befallsrate der Tiere mit Fadenwürmern der Arten Anisakis simplex, Anisakis typica, Stenurus glocicephalus und Stenurus auditivus[9] sowie Kratzwürmern der Art Bolbosoma capitatum festgestellt. Dabei betrug die Dichte der Kratzwürmer bis zu 600 Individuen pro Meter Darmlänge. Zudem wurden nicht näher identifizierte Bandwürmer der Familie Tetrabothriidae festgestellt.[15] Bolbosoma capitatum und Anisakis simplex wurden auch früher bereits bei Kleinen Schwertwalen sowie bei zahlreichen anderen Walen nachgewiesen, hinzu kommt die Dokumentation der Saugwürmer Nasitrema attenuata,[21] Nasitrema globicephalae und Orthosplanchnus elongatus.[9] Als Ektoparasiten konnten am Körper der Tiere Walläuse (Syncyamus pseudorcae, Isocyamus delphini)[9], Seepocken wie Xenubalanus globicipitus[9] und die zu den Entenmuscheln gehörenden Conchoderma auritum festgestellt werden.[22]
Über Infektionskrankheiten liegen nur sporadische Informationen vor, so wurde bei in Gefangenschaft gehaltenen Tieren akute Lungenentzündung nachgewiesen.[9]
Systematik
Taxonomiegeschichte und Fossilgeschichte

Die Erstbeschreibung des Kleinen Schwertwales stammt von 1846 anhand eines 1843 aus einem Torfmoor in Lincolnshire geborgenen Fossils durch den Zoologen und Paläontologen Richard Owen, der in den Überresten das Skelett eines Wales erkannte, den er für eine womöglich ausgestorbene Spezies der Delphinidae hielt.[23] Er bezeichnete die Überreste als subfossil, also in neuerer Zeit konserviert, und datierte den Fund auf das mittlere Pleistozän mit einem Alter von etwa 126,000 Jahren. Er benannte den Typus Phocaena crassidens, damit stellte er ihn in die Verwandtschaft der Schweinswale.[23] John Edward Gray ordnete die Art 1846 in seiner Beschreibung der Wale in dem Werk The Zoology of the Voyage of H.M.S. Erebus and Terror, einer Reisebeschreibung der Antarktis-Expedition durch James Clark Ross von 1839 bis 1843, direkt in die Gattung Orca (heute Orcinus) als Orca crassidens ein.[24] Lebend gefunden wurde die Art erstmals durch Johannes T. Reinhardt, der 1861 eine Gruppe in der Kieler Bucht gestrandeter Wale untersuchte und sie als eine neue, den Schwertwalen (Orcinus orca) nahestehende Gattung ansah, die er 1862 Pseudorca nannte und in die er die von Owen beschriebenen Überreste gemeinsam mit den von ihm beschriebenen lebenden Exemplaren als Pseudorca crassidens einordnete.[25][26] William Henry Flower beschrieb 1864 mit Orca meridionalis eine für ihn neue Art der Schwertwale aus Tasmanien,[27] die er im Jahr darauf zu Pseudorca verwies[28] und welche später synonymisiert wurde. Weitere heute als Synonyme betrachtete Artbeschreibungen sind Orca destructor Cope, 1866[29], Pseudorca grayi Burmeister, 1869[30] und Pseudorca mediterranea Giglioli, 1882[31].
1924 wurde durch den japanischen Wirbeltierpaläontologen Hikoshichiro Matsumoto auf der Basis zweier fossiler Zähne aus Japan die fossile Art Pseudorca yokoyamai als bisher einziger fossiler Vertreter der Gattung beschrieben. Sie wurde auf das Calabrium, eine Teilepoche des Unteren Pleistozäns vor 1,806–0,781 Millionen Jahren, datiert.[32][33]
Äußere Systematik
Tatsächlich wurde der Kleine Schwertwal lange Zeit als nahe verwandt zum Großen Schwertwal angesehen und mit diesem gemeinsam in eine Unterfamilie Orcinae innerhalb der Zahnwale und der Delfine platziert. Genetische Untersuchungen zeigen den Kleinen Schwertwal (Pseudorca crassidens) jedoch mit den Grindwalen näher verwandt als mit dem Großen Schwertwal (Orcinus orca).[34][35]
Phylogenetische Systematik der Delphinidae nach Horreo 2018[35]
|
Dabei bilden sie nach aktuellen Studien wahrscheinlich die Schwesterart eines Taxons aus den beiden bekannten Arten der Grindwale (Globicephala) sowie dem Breitschnabeldelfin (Peponocephala electra) und dem Zwerggrindwal (Feresa attenuata).[35] Diese Arten formen gemeinsam mit dem Rundkopfdelfin (Grampus griseus) die Unterfamilie Globicephalinae innerhalb der Delfine und werden den beiden Arten der Gattung Orcaella gegenübergestellt.[35]
Innere Systematik
William Henry Flower schlug bereits 1888 vor, eine nördliche von einer südlichen Form zu unterscheiden und Paules Edward Pieris Deraniyagala trennte 1945 Pseudorca crassidens meridionalis als eigenständige Unterart ab, allerdings ohne konkrete Benennung von Merkmalen, anhand derer die beiden Unterarten voneinander getrennt werden könnten. Diese Beschreibung wird entsprechend generell ignoriert und bis heute wird die Art entsprechend als monotypisch ohne Unterarten betrachtet.[1][36]
Allerdings konnten durch genetische Tests voneinander isolierte Populationen und unterschiedliche Haplotypen in verschiedenen Meeresbereichen identifiziert werden,[37][38] zudem gibt es auch morphologische Unterschiede vor allem im Schädelbau zwischen Individuen aus Australien, Schottland, den Gewässern um Hawaii und Südafrika.[39][36] Im Fall der genetischen Diversität der Kleinen Schwertwale im Chinesischen Meer waren die genetischen Unterschiede der Haplotypen nach Ansicht der Autoren so groß, dass die Frage aufgeworfen wurde, ob es sich dabei nicht um unterschiedliche Arten handeln könnte.[38] Im Bereich um Hawaii wurde dokumentiert, dass es genetische Unterschiede zwischen den küstennah lebenden Tieren sowie denen des offenen Pazifik gibt.[37]
Namensgebung
Der Kleine Schwertwal ist auch bekannt als Falscher Schwertwal oder Falscher Mörderwal, im englischen Sprachraum wird er als false killer whale bezeichnet. Wie der wissenschaftliche Gattungsname Pseudorca bezieht sich diese Namensgebung auf die äußerliche Ähnlichkeit zum Großen Schwertwal (Orcinus orca), der auch als Mörderwal oder Orca bekannt ist.[4] Der wissenschaftliche Artname „crassidens“ verweist auf die Form der Zähne („crassus“ = „dick“ und „dens“ = Zähne).
Status und Bedrohung
Der Kleine Schwertwal ist ein Spitzenprädator und wird generell als eher selten angesehen, selbst in den Regionen mit den höchsten Bestandsdichten. Die Dichte ist in den niedrigeren Breitengraden im Bereich des Äquators generell höher; im Nordpazifik nimmt die Dichte nördlich von etwa 15 ° nördlicher Breite massiv ab.[3] Für eine Reihe von Gebieten gibt es Bestandsschätzungen, die allerdings zum Teil recht veraltet sind, und die Schätzungen für größere Gebiete können mehr als eine Population umfassen. Das einzige Gebiet, zu dem sowohl aktuelle Bestandsschätzungen als auch eine gute Vorstellung von der Populationsstruktur vorliegen, betrifft die hawaiianischen Gewässer. Dort gibt es drei etablierte Populationen mit teilweise überlappenden Territorien. Die Hauptinselpopulation zählt zwischen 150 und 200 Individuen und nutzt ein Gebiet um die Hauptinseln Hawaiis, das bis zu 120 Kilometer von der Küste entfernt ist. Die Population der nordwestlichen Hawaii-Inseln zählt etwa 550 Individuen. Die pelagische Population lebt mindestens 1700 Kilometer von Hawaii entfernt und besteht innerhalb der Wirtschaftszone der Hawaii-Inseln aus etwa 1550 Individuen.[40][3] Die Gesamtsumme der vorhandenen Abschätzungen für die weltweite Gesamtzahl der Tiere beträgt etwa 60.000 Tiere, wobei die beiden größten Schätzungen, die etwa 94 % der Gesamtzahl ausmachen, mehr als 25 Jahre alt sind. Für einen wesentlichen Teil des Verbreitungsgebietes der Art liegen keine Abundanzschätzungen vor, und daher ist die Gesamthäufigkeit wahrscheinlich viel höher als diese 60.000 Tiere. Aufgrund der geringen Dichte dieser Wale sind die Schätzungen allerdings nur ungenau, und es ist in den meisten Gebieten nicht möglich, Trends zu beurteilen.[6]
.JPG.webp)
Die International Union for Conservation of Nature stuft den Kleinen Schwertwal als Art der Vorwarnliste (near threatened) ein, wobei vor der aktuellen Datenlage eine Einordnung nahe der Gefährdungsstufe vulnerable angegeben wird.[6] Als Hauptbedrohungen für die Bestände werden die unbeabsichtigte Tötung als Beifang in der Fischerei und, in einigen Gebieten, die gezielte Jagd oder Tötung der Tiere angesehen.[6] Aufgrund der vergleichsweise langen Generationendauer von etwa 25 Jahren und der damit zusammenhängenden langsamen Populationsentwicklung können bereits vergleichsweise niedrige Tötungsraten beim Kleinen Schwertwal zu einer negativen Bestandsentwicklung führen.[6] Der Kleine Schwertwal fällt wie alle Kleinwale nicht unter die Schutzbestimmungen der Internationalen Walfangkommission (IWC), im Washingtoner Artenschutzübereinkommen ist er im CITES Anhang II gelistet. Die hawaiianische Population wird im U.S. Endangered Species Act als bedroht (endangered) eingeordnet.[3][41]
Neben der direkten Fischerei und der Tötung der Tiere als Fischereikonkurrenten gibt es weitere Bedrohungen der Tiere durch Umweltbelastungen und Umweltverschmutzungen. Der Kleine Schwertwal gehört zu den Arten, bei denen die Aufnahme von weggeworfenem Plastik festgestellt wurde. In Geweben, die von gestrandeten Tieren gesammelt wurden, ließen sich teilweise hohe Gift- und Schwermetallmengen dokumentieren.[4] Bei gestrandeten Tieren in Südamerika wurden sehr hohe Silberkonzentrationen in den Organen der Wale registriert[42] und in einer anderen Untersuchung bei gestrandeten Walen in Chile fand sich eine sehr hohe Konzentration von Selen und Quecksilber in Gewebeproben.[43] In hawaiianischen Gewässern wiesen bei einer Untersuchung 84 % der beprobten Wale Polychlorierte Biphenyle (PCB) in Konzentrationen auf, die die vorgeschlagenen Gesundheitsschwellenwerte deutlich übersteigen, was darauf hindeutet, dass eine Immunsuppression oder Auswirkungen auf die Fortpflanzung in den betroffenen Populationen vorliegen könnten.[44][3] Auch Dichlordiphenyldichlorethen, ein Abbauprodukt des Pflanzenschutzmittels Dichlordiphenyltrichlorethan (DDT), konnte teilweise in hoher Konzentration nachgewiesen werden.[9]
Interaktionen mit dem Menschen
Fischerei und Beifang


.JPG.webp)
In Europa gab es nie eine gezielte wirtschaftliche Nutzung des Kleinen Schwertwales, er wird allerdings gelegentlich als Beifang im Thun- und Schwertfischfang erbeutet. In Japan nutzt man die Tiere gelegentlich als Nahrungsquelle, wobei meist in Strandnähe auftauchende Tiere ans Ufer getrieben und dort harpuniert und getötet werden.[9] Zudem wurden sie auch in St. Vincent und Taiwan gefangen und als Nahrungs- und Ölquelle genutzt. Angesichts der hohen Anzahl der gefangenen Tiere in einigen Gebieten, in denen dies untersucht wurde, könnte das Töten dieser Wale einen erheblichen Einfluss auf die lokale Population gehabt haben.[3]
In allen Gebieten, in denen sich die Lebensräume des Kleinen Schwertwals mit den Fischfanggebieten kommerzieller Großfischerei überschneiden, kommt es zu Verletzungen und Tötungen als Beifang der Fischereiindustrie. Das geschieht unabhängig davon, ob es sich um Schleppnetz-, Langleinen- oder Hakenfischerei handelt.[3] In den gut untersuchten hawaiianischen Gewässern ist die Zahl der getöteten und verletzten Tiere, die bei der Langleinenfischerei zufällig getötet oder schwer verletzt werden, wahrscheinlich größer, als die Population dauerhaft überleben kann,[4] und es wird angenommen, dass dies auch für fast alle anderen Fangbereiche gilt. Zudem kommt es indirekt zur Beeinflussung der Populationen und ihrer Nahrungsversorgung in Gebieten, in denen ein hoher Anteil der Fischpopulationen kommerziell interessant ist und genutzt wird.[3]
Bei kommerziellen Fischern ist diese Art wenig beliebt, da sie bereits gefangene Thunfische von den Leinen stiehlt.[45] Dadurch erhöht sich zudem die Gefahr für die Tiere, selbst gefangen zu werden.[6] So gab es auf der japanischen Insel Iki eine konzertierte Aktion der Fischer, die Art in der Region auszurotten. Hierbei wurden zwischen 1965 und 1990 neunhundert Kleine Schwertwale in der Umgebung von Iki getötet.[3][1]
Walbeobachtung und Haltung
In Hawaii und auch in anderen Regionen wie vor Neuseeland oder vor Marokko werden die Tiere regelmäßig von kommerziellen Wal- oder Delfinbeobachtungsschiffen angetroffen. Kleine Schwertwale wurden und werden zudem zu wissenschaftlichen Zwecken und zur Unterhaltung in einer Reihe von Aquarien auf der ganzen Welt in Gefangenschaft gehalten, unter anderem in Japan, den Vereinigten Staaten, den Niederlanden, Hongkong und Australien. Sie wurden an verschiedenen Orten erfolgreich in Gefangenschaft gezüchtet, teilweise entstanden in Gefangenschaft auch lebensfähige Hybriden mit Großen Tümmlern.[4]
Strandungen
Wie bei anderen Walen kommt es auch beim Kleinen Schwertwal mehr oder weniger regelmäßig zu Strandungen, die teilweise ganze Schule oder größere Gruppen betreffen. Sie sind jedoch vergleichsweise selten im Vergleich zu den bekannteren Arten der Delfine.
Die größte dokumentierte Strandung von Tieren dieser Art passierte 1946 in Mar del Plata (Argentinien) und bestand aus 835 Individuen.[3] Im Gegensatz zu anderen Delfinen, aber ähnlich wie bei Grindwalen stranden die Kleinen Schwertwale in der Regel in großen Gruppen, was zu vergleichsweise hohen Sterblichkeitsraten führt. Diese können auch in gemäßigten Gewässern außerhalb seines zentralen Verbreitungsgebietes auftreten, wie etwa bei den Massenstrandungen in Großbritannien oder Dänemark. Die Gründe für die Strandungen sind weitgehend unbekannt. Man geht davon aus, dass sie aufgrund von Fehlorientierungen einzelner Tiere passieren, denen dann die gesamte Gruppe folgt.[9] Wahrscheinlich spielen auch Umweltbedingungen wie Gewässerverschmutzungen und Schallemissionen, Erkrankungen oder Vergiftungen der Tiere und andere Faktoren eine Rolle.
Die Massenstrandung von 114 Kleinen Schwertwalen am 30. Juli 1986 in Flinders Bay, Westaustralien, wurde von vielen Menschen international beobachtet und erhielt viel Presseresonanz. Durch das neu geschaffene australische Department of Conservation and Land Management (CALM) konnten 96 Tiere gerettet werden und es wurde ein informelles Netzwerk für Walstrandungen gegründet.[46][47] Die Strandung von 120 Tieren in der Geographe Bay am 2. Juni 2005 in Westaustralien, die vierte in dieser Bucht, wurde durch einen Sturm verursacht, der die Tiere daran hinderte, die Uferlinie zu sehen. Auch hier wurde eine Rettungsaktion gestartet, an der 1500 Freiwillige durch CALM organisiert wurden.[48]
Zahlreiche weitere Strandungen wurden und werden dokumentiert, wobei sie in fast allen Regionen des Verbreitungsgebietes vorkommen. So gab es seit 2005 mindestens sieben Strandungen in Neuseeland und auch aus Südafrika[49] und Florida[50] wurden Massenstrandungen aus den letzten Jahren gemeldet.
Literatur
- J.Y. Wang, K.N. Riehl, S.Z. Dungan: Family Delphinidae (Ocean Dolphins); False Killer Whale Pseudorca crassidens In: Don E. Wilson, Russell A. Mittermeier, Anthony B Rylands, Martina Anandam, Gill Braulik: Handbook of the Mammals of the World. Band 4: Sea Mammals. Lynx Edicions, Barcelona 2014, ISBN 978-84-96553-93-4, S. 520–521.
- Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species. Band 456, 2. Juni 1994, S. 1–6 (Volltext).
- J. Niethammer, F. Krapp (Hrsg.): Handbuch der Säugetiere Europas. Band 6: Meeressäuger, Teil 1A: Wale und Delphine 1. AULA-Verlag, Wiesbaden 1995, ISBN 978-3-89104-559-6.
- R. R. Reeves, B. S. Stewart, P. J. Clapham, J. A. Powell: Sea Mammals of the World. A Complete Guide to Whales, Dolphins, Seals, Sea Lions and Sea Cows. Black, London 2002, ISBN 978-0-7136-6334-1.
Einzelnachweise
- J.Y. Wang, K.N. Riehl, S.Z. Dungan: Family Delphinidae (Ocean Dolphins); False Killer Whale Pseudorca crassidens In: Don E. Wilson, Russell A. Mittermeier: Handbook of the Mammals of the World. Band 4: Sea Mammals. Lynx Edicions, Barcelona 2014, ISBN 978-84-96553-93-4, S. 520–521.
- „Diagnosis“, „General Characteristics“ und „Form“. In: Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species. Band 456, 2. Juni 1994; S. 1–3 (Volltext).
- Robin W. Baird: False Killer Whale: Pseudorca crassidens. In: B. Würsig, J. G. M. Thewissen, K. Kovacs: Encyclopedia of Marine Mammals. 3rd edition. Elsevier Inc., London 2018, ISBN 978-0-08-091993-5, S. 347–349 (Volltext).
- Robin W. Baird: False Killer Whale: Pseudorca crassidens. In: W. F. Perrin, B. Würsig, J. G. M. Thewissen (Hrsg.): Encyclopedia of marine mammals. Elsevier/ Academic Press, Amsterdam/ Boston (Mass.) 2009, ISBN 978-0-08-091993-5, S. 405–406 (Volltext).
- „Genetics“. In: Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species Band 456, 2. Juni 1994; S. 4 (Volltext).
- Pseudorca crassidens in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: R.W. Baird, 2018. Abgerufen am 3. März 2020.
- „Distribution“. In: Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species. Band 456, 2. Juni 1994; S. 2 (Volltext).
- Jochen R. Zaeschmar, Sarah L. Dwyer, Karen A. Stockin: Rare observations of false killer whales (Pseudorca crassidens) cooperatively feeding with common bottlenose dolphins (Tursiops truncatus) in the Hauraki Gulf, New Zealand. In: Marine Mammal Science. Band 29, Nr. 3, Juli 2013, S. 555–562, doi:10.1111/j.1748-7692.2012.00582.x.
- „Ecology“ und „Behaviour“. In: Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species. Band 456, 2. Juni 1994; S. 3–4 (Volltext).
- Conor Ryan, Martin Cohen, Robin W. Baird: Letter to the Editor Southernmost Record of False Killer Whale (Pseudorca crassidens). In: Aquatic Mammals. Band 46, Nr. 1, 2020, S. 111–113, doi:10.1578/AM.46.1.2020.111, Volltext.
- Sarah Crofts, Karen K. Martien, Kelly M. Robertson, Andrew Stanworth, Steve Massam, Caroline R. Weir: First record of false killer whales (Pseudorca crassidens) in the Falkland Islands (Malvinas). In: Polar Biology. Band 42, 2019, S. 1923–1929, doi:10.1007/s00300-019-02554-9.
- Robin W. Baird, K. M. Langelier, P. J. Stacey: First records of false killer whales, Pseudorca crassidens, in Canada. In: Canadian Field-Naturalist. Band 103, 1989, S. 368–371 (Volltext).
- Jochen R. Zaeschmar, Ingrid N. Visser, Dagmar Fertl, Sarah L. Dwyer, Anna M. Meissner, Joanne Halliday, Jo Berghan, David Donnelly, Karen A. Stockin: Occurrence of false killer whales (Pseudorca crassidens) and their association with common bottlenose dolphins (Tursiops truncatus) off northeastern New Zealand. In: Marine Mammal Science. Band 30, Nr. 2, April 2014; S. 594–608, doi:10.1111/mms.12065.
- Robin W. Baird, Antoinette M. Gorgone, Daniel J. McSweeney, Daniel L. Webster, Dan R. Salden, Mark H. Deakos, Allan D. Ligon, Gregory S. Schorr, Jay Barlow, Sabre D. Mahaffy: False killer whales (Pseudorca crassidens) around the main Hawaiian Islands: Long‐term site fidelity, inter‐island movements, and association patterns. In: Marine Mammals Science. Band 24, Nr. 3, Juli 2008; S. 591–612, doi:10.1111/j.1748-7692.2008.00200.x.
- A. L. V. Andrade, M. C. Pindeo, A. S. Barreto: Gastrointestinal parasites and prey items from a mass stranding of False Killer Whales (Pseudorca crassidens), in Rio Grande Do Sul, Southern Brazil. In: Revista Brasileira de Biologia. Band 61, Nr. 1, Februar 2001, doi:10.1590/S0034-71082001000100008.
- Daniel M. Palacios, Bruce R. Mate: Attack by false killer whales (Pseudorca crassidens) on sperm whales (Physeter macrocephalus) in the Galápagos Islands. In: Marine Mammals Science. Band 12, Nr. 4, Oktober 1996; S. 582–587, doi:10.1111/j.1748-7692.1996.tb00070.x.
- „Reproduction“. In: Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species Band 456, 2. Juni 1994; S. 3 (Volltext).
- Theoni Photopoulou, Ines M. Ferreira, Peter B. Best, Toshio Kasuya, Helene Marsh: Evidence for a postreproductive phase in female false killer whales Pseudorca crassidens. In: Frontiers in Zoology. Band 14, 2017, doi:10.1186/s12983-017-0208-y.
- Giuseppe Notarbartolo‐di‐Sciara, Giorgio Barbaccia, Arianna Azzellino: Birth at sea of a False Killer Whale, Pseudorca crassidens. In: Marine Mammal Science. Band 13, Nr. 3, Juli 1997; S. 508–511, doi:10.1111/j.1748-7692.1997.tb00660.x.
- Ingrid Natasha Visser, Jochen R Zaeschmar, Jo Halliday et al.: First Record of Predation on False Killer Whales (Pseudorca crassidens) by Killer Whales (Orcinus orca). In: Aquatic Mammals. Band 36, Nr. 2, Juni 2010; S. 195–204, doi:10.1578/AM.36.2.2010.195.
- John R. Felix: Reported Incidences of Parasitic Infections in Marine Mammals from 1892 to 1978. Zea Books, Lincoln (Nebraska) 2013, S. 11, 72, 108 (Volltext).
- Vicente Hernández-García: Contents of the digestive tract of a False Killer Whale (Pseudorca crassidens) stranded in Gran Canaria (Canary Islands, Central East Atlantic). In: Bulletin of Marine Science. Band 71, Nr. 1, 2002; S. 367–369 (Volltext).
- Richard Owen: A history of British fossil mammals, and birds. Van Voorst, London 1846, S. 516–520 (Digitalisat).
- John Edward Gray: On the cetaceous animals. In: John Richardson, John Edward Gray (Hrsg.): The Zoology of the Voyage of H.M.S. Erebos and Terror under the command of Captain Sir James Clark Ross, R.N.F.R.S., during the years 1839 to 1843. London 1864, S. 13–53.
- Johannes T. Reinhardt: Om en for den danske fauna ny Delphinart (Pseudorca crassidens Owen). Oversight over det Koniglige Danske Videnskabernes Selskabs Forhandlinger, Kopenhagen 1862, S. !03-152.
- Johannes T. Reinhardt: Pseudorca crassidens, a cetacean hitherto unknown in the Danish fauna. In: W.H. Flower (Hrsg.): Recent memoirs on the Cetacea. Ray Society of London, 1866, S. 189–218.
- William Henry Flower: On a new species of grampus (Orca meridionalis) from Tasmania. In: Proceedings of the Zoological Society of London. 1864, S. 420–426 (Digitalisat).
- William Henry Flower: Note on “Pseudorca meridionalis”. In: Proceedings of the Zoological Society of London. 1865, S. 470–471 (Digitalisat).
- Edward Drinker Cope: Third contribution to the history of the Balaenidae and Delphinidae. In: Proceedings of the Academy of Natural Sciences of Philadelphia. 1866, S. 293–300 (Digitalisat).
- Hermann Burmeister: Descripcion de custro especies de Delphinides. In: Anales Museo Publico Buenos Aires. 1869, S. 367–445.
- Enrico Hillyer Giglioli: Note intorno un nuevo Cetaceo nel Mediterraneo da riferisi propabilmente el genera Pseudorca. In: Zoologischer Anzeiger. Band 5, Nr. 112, 1882, S. 288–290.
- Hikoshichiro Matsumoto: On some fossil cetaceans of Japan. In: Scientific reports of Tokoku Imperial University, Sendai, Japan, second series (geology). Band 10, 1926, S. 17–27 (Volltext).
- „Fossil Record“. In: Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species. Band 456, 2. Juni 1994; S. 2 (Volltext).
- Laura May-Collado, Ingi Agnarsson: Cytochrome b and Bayesian inference of whale phylogeny (PDF; 401 kB).
- José L. Horreo: New insights into the phylogenetic relationships among the oceanic dolphins (Cetacea: Delphinidae). In: Journal of Zoological Systematics and Evolutionary Research. Band 57, Nr. 2, Mai 2019; S. 476–480, doi:10.1111/jzs.12255.
- Pam J. Stacey, Stephen Leatherwood, Robin W. Baird: Pseudorca crassidens. In: Mammalian Species. Band 456, 2. Juni 1994; S. 1–6 (Volltext).
- Susan J. Chivers, Robin W. Baird, Daniel J. McSweeney, Daniel L. Webster, Nicole M. Hedrick, Juan Carlos Salinas: Genetic variation and evidence for population structure in eastern North Pacific false killer whales (Pseudorca crassidens). In: Canadian Journal of Zoology. Juli 2007, S. 783–794,doi:10.1139/Z07-059.
- Zhang Ting, Yang Guang, Zhou Kaiya, Wei Fuwen: An initial study on the mitochondrial DNA control region sequences of false killer whales (Pseudorca crassidens). In: Acta Theriologica Sinica. Band 25, Nr. 3, 1. Januar 2005, S. 219–223 (Abstract).
- D. J. Kitchener, G. J. B. Ross, N. Caputi: Variation in skull and external morphology in the False Killer Whale, Pseudorca crassidens, from Australia, Scotland and South Africa. In: Mammalia. Band 54, Nr. 1, 1990, S. 119–135, doi:10.1515/mamm.1990.54.1.119.
- Amanda L. Bradford, Karin A. Forney, Erin M. Oleson, Jay Barlow: Accounting for Subgroup Structure in Line-Transect Abundance Estimates of False Killer Whales (Pseudorca crassidens) in Hawaiian Waters. In: Plos One. 28. Februar 2014, doi:10.1371/journal.pone.0090464.
- E. M. Oleson, C. H. Boggs, K. A. Forney, M. B. Hanson, D. R. Kobayashi, B. L. Taylor, P. R. Wade, G. M. Ylitalo: Status review of Hawaiian insular false killer whales (Pseudorca crassidens) under the Endangered Species Act. NOAA Technical Memorandum NMFS-PIFSC-22, August 2010 (Download).
- Iris Cáceres-Saez, Daniela Haro, Olivia Blank, Anelio Aguayo-Lobo, Catherine Dougnac, Cristóbal Arredondo, H. Luis Cappozzoa, Sergio Ribeiro Guevara: Stranded false killer whales, Pseudorca crassidens, in Southern South America reveal potentially dangerous silver concentrations. In: Marine Pollution Bulletin. Band 145, August 2019, S. 325–333, doi:10.1016/j.marpolbul.2019.05.047.
- Iris Cáceres-Saez, Daniela Haro, Olivia Blank, Anelio Aguayo Lobo, Catherine Dougnac, Cristo bal Arredondo, H. Luis Cappozzo, Sergio Ribeiro Guevara: High status of mercury and selenium in false killer whales (Pseudorca crassidens, Owen 1846) stranded on Southern South America: A possible toxicological concern? In: Chemosphere. Band 199, 2018, S. 637–646, doi:10.1016/j.chemosphere.2018.02.046.
- Kerry M. Foltz, Robin W. Baird, Gina M. Ylitalo, Brenda A. Jensen: Cytochrome P4501A1 expression in blubber biopsies of endangered false killer whales (Pseudorca crassidens) and nine other odontocete species from Hawai‘i. In: Ecotoxicology. Band 23, 2014, S. 1607–1618. doi:10.1007/s10646-014-1300-0.
- Cecilia Passadore, Andrés Domingo, Eduardo R. Secchi: Depredation by killer whale (Orcinus orca) and false killer whale (Pseudorca crassidens) on the catch of the Uruguayan pelagic longline fishery in Southwestern Atlantic Ocean. In: ICES Journal of Marine Science. Band 72, Nr. 5, Mai/ Juni 2015, S. 1653–1666, doi:10.1093/icesjms/fsu251.
- Sharon Kennedy: Whale rescue in 1986 changed not just the people who were there. In: ABC South West. 7. Juni 2011; abgerufen am 28. März 2020.
- Malcolm Quekett: World watched as WA town saved the whales. In: The West Australian. 19. Juli 2011; abgerufen am 28. März 2020.
- Jan Martin: No further sightings of stranded whales – CALM In: NatureBase. 3. Juni 2005; abgerufen am 28. März 2020.
- Stephen Kirkman, M.A. Meyer, Meredith Thornton: False killer whale Pseudorca crassidens mass stranding at Long Beach on South Africa’s Cape Peninsula, 2009. In: African Journal of Marine Science. Band 32, Nr. 1, Juni 2010, S. 167, doi:10.2989/1814232X.2010.481168.
- Jenny Staletovich: Mysterious stranding kills 81 false killer whales off Southwest Florida. In: Miami Herald. 16. Januar 2017; abgerufen am 28. März 2020.
Weblinks
- falsekillerwhales.org, Forschungsprojekt von Cascadia Research, Hawaii
- Pseudorca crassidens in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: R.W. Baird, 2018.
- Pseudorca crassidens im World Register of Marine Species (WoRMS)