Camptothecin
Camptothecin ist ein natürlich im Chinesischen Glücksbaum (Camptotheca acuminata) vorkommendes Alkaloid. Die Substanz wurde 1966 im Rahmen eines Screenings nach in der Natur vorkommenden potenziellen Krebs-Therapeutika von Monroe E. Wall und Mansukh C. Wani entdeckt.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
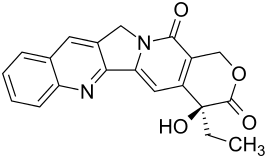 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Camptothecin | ||||||||||||||||||
| Andere Namen |
(S-)4-Ethyl-4-hydroxy-1H-pyrano[3',4':6,7]indolizino[1,2-b]chinolin-3,14-(4H,12H)-dion (IUPAC) | ||||||||||||||||||
| Summenformel | C20H16N2O4 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 348,36 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Camptothecin wirkt zelltoxisch; das pentacyclische Chinolin-Alkaloid bildet ein planares Ringsystem und besteht aus einem Chinolin-Bicyclus sowie einem teilhydrierten Indolizin-Doppelring, an den ein weiterer Tetrahydropyran-Ring anelliert ist. Das Chinolinalkaloid Camptothecin hemmt das Enzym Topoisomerase I und zeigte in klinischen Studien eine zytostatische Wirksamkeit. Aufgrund ungünstiger physikochemischer und pharmakologischer Eigenschaften findet Camptothecin jedoch keine Anwendung in der Krebstherapie. Weiterentwicklungen des Camptothecins, Topotecan und Irinotecan, sind für die Behandlung maligner Tumoren zugelassen.
Die Totalsynthese gelang 1972 Ekkehard Winterfeldt.
Vorkommen

Camptothecin wird aus der Rinde und Wurzeln, den Samen und aus dem Holz, sowie auch (jungen) Blättern von Camptotheca acuminata dem Chinesischen Glücksbaum, einem zu den Tupelogewächsen (Nyssaceae) gehörenden chinesischen Baum, isoliert. Auch in den übrigen Teilen dieser Pflanze kann das Alkaloid nachgewiesen werden. Der höchste Camptothecingehalt ist in den jungen Blättern und Blütenknospen enthalten. Etwas geringer ist der Alkaloidgehalt in den Früchten und Samen, Wurzeln und in der Rinde.
Abgesehen von seinem Vorkommen in Camptotheca acuminata konnte Camptothecin sporadisch bei einzelnen Vertretern kaum miteinander verwandter Familien innerhalb der Samenpflanzen nachgewiesen werden. So gelang ein positiver Nachweis in Pyrenacantha klaineana, Merrilliodendron megacarpum, Nothapodytes foetida (Icacinaceae), Ophiorrhiza spp. (Rubiaceae) sowie Tabernaemontana alternifolia (Syn.: Ervatamia heyneana) und Mostuea brunonis (Gelsemiaceae). Camptothecin kann darüber hinaus auch in Wurzelkulturen, sogenannten Hairy Root Cultures, von Camptotheca acuminata oder Ophiorrhiza pumila produziert werden.[4]
Biosynthese
Wenngleich Camptothecin keine Indolstruktur, sondern eine Chinolinstruktur besitzt, gehört Camptothecin biogenetisch zu den iridoiden Indolalkaloiden. Wie alle Vertreter dieser Gruppe leitet sich auch Camptothecin von der Aminosäure Tryptophan und dem Loganin ab, welches dem Terpenstoffwechsel entstammt.[1] Nach der intermediären Bildung von Strictosidin und enzymatischer Oxidation des vom Loganin stammenden Rings E erfolgt eine Umlagerung zum Camptothecin als Endprodukt der Biosynthese.[5]
Pharmakologie
Wirkmechanismus
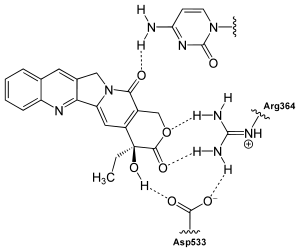
Camptothecin ist ein Hemmstoff der Topoisomerase I, deren physiologische Funktion darin besteht, den Scherungsstress des DNA-Doppelstranges zu mindern. Diese hemmende Wirkung vermittelt das Alkaloid über eine gleichzeitige Anbindung an die Topoisomerase I und an die an das Enzym gebundene DNA mit Hilfe von Wasserstoffbrückenbindungen. An der Interaktion mit der Topoisomerase I ist einerseits insbesondere der Ring E des Camptothecins, der mit den Aminosäureresten Asparaginsäure-533 und Arginin-364 des Enzyms interagiert, beteiligt. Andererseits ist der Lactam-Sauerstoff des Rings D für eine Wechselwirkung mit der DNA, die vorrangig über Cytosin-Gruppen in Position +1 erfolgt, verantwortlich.[6][7] Damit stabilisiert Camptothecin den Topoisomerase-I-DNA-Komplex und verhindert somit den Wiederverschluss (Re-Ligation) der DNA nach deren Entwindung. Da die DNA nicht wieder verschlossen wird, sind nicht nur Einzelstrangbrüche, sondern als Folge auch Doppelstrangbrüche möglich. Diese führen zum programmierten Zelltod (Apoptose). Die Wirksamkeit von Camptothecin ist auf die S-Phase des Zellzyklus, in der auch die DNA-Synthese stattfindet, beschränkt.
Chemie
Stereochemie
Camptothecin ist ein chiraler Arzneistoff mit einem Stereozentrum in Position 20 im Ring E. Für seine pharmakologische Wirkung ist eine S-Konfiguration essenziell; R-Camptothecin ist pharmakologisch inaktiv.
Struktur-Wirkungsbeziehungen

Um die zytostatische Wirksamkeit des Camptothecins zu optimieren und zugleich seine unerwünschten pharmakologischen und physikochemischen Eigenschaften zu reduzieren, wurden zahlreiche Modifikationen an der Molekülstruktur vorgenommen. Als essenziell für eine zytostatische Wirksamkeit haben sich die S-konfigurierte Hydroxygruppe in Position 20, das 2-Pyridonelement im Ring D, die Lactonstruktur im Ring E und die weitgehende Planarität des gesamten Ringsystems herausgestellt. Änderungen dieser Parameter führen zu einem drastischen Wirkungsverlust.[8]
Ringsystem A/B
Die am meisten versprechenden Veränderungen der Molekülstruktur des Camptothecins betreffen die Substituenten an den Ringen A und B. Diese spielen auch bei den therapeutisch eingesetzten Camptothecinderivaten Irinotecan und Topotecan die entscheidende Rolle. Eine Mono- oder Disubstitution an den Positionen 9 und 10 mit elektronenreichen Substituenten, wie OH-, NH2- oder Halogengruppen, führt ebenso wie eine Monosubstitution an Position 11 zu einer Wirkungssteigerung. Eine Disubstitution in den Positionen 10 und 11 ist hingegen mit einem Wirkungsverlust verbunden. Als eine Ausnahme von dieser Regel sind die hexazyklischen Camptothecinderivate wie beispielsweise Lurtotecan anzusehen, die an den Positionen 10 und 11 über Methylendioxy- oder Ethylendioxy-Gruppen miteinander verbunden sind und eine gesteigerte Topoisomerase-I-hemmende Wirkung besitzen. Eine Substitution an Position 12 ist generell mit einem drastischen Wirkungsverlust verbunden. Über den Substituenten in Position 7 lässt sich die Löslichkeit und die Affinität zur DNA modulieren.
Ringsystem C/D
Deutlich kritischer als die beschriebenen Substitutionen am Chinolinringsystem sind die Substitutionen an den Ringen C und D. Substitutionen in den Positionen 5 und 14 führen im Allgemeinen zu einer Reduktion der Topoisomerase-I-inhibitorischen Wirksamkeit.
Ringsystem E
Wesentlich mehr Modifikationen erlaubt der Ring E. Ein Austausch der Hydroxygruppe gegen eine Amino- oder Halogengruppe in Position 20, die mit der Lactongruppe über eine intramolekulare Wasserstoffbrückenbindung interagiert und die für die relative Instabilität des Lactonrings verantwortlich ist, führt zu einem Wirkungsverlust. Die Hydroxygruppe in Position 20 wird zudem als essenzieller Protonendonator für eine Interaktion mit der Topoisomerase I über intermolekulare Wasserstoffbrückenbindungen angesehen. Eine Veresterung dieser Gruppe, wie im Fall der Polymerkonjugate Protecan und Pegamotecan, führt zu Prodrugs mit erhöhter Stabilität des Lactonrings, reduzierter In-vitro-Zytotoxizität und ggf. erhöhter In-vivo-Tumoraktivität.[9] Alternativ dazu hat eine Ringerweiterung unter Bildung eines β-Hydroxylactons nicht nur eine Erhöhung der physikochemischen Stabilität, sondern auch eine Steigerung der Topoisomerase-I-hemmenden Wirkung zur Folge.[10]
Derivate
Ausgehend vom Camptothecin wurden durch strukturelle Modifikationen neue Arzneistoffe (z. B. Atiratecan) entwickelt, die in klinischen Studien getestet wurden und, wie im Falle von Topotecan und Irinotecan, zur Chemotherapie maligner Tumoren zugelassen wurden. Die strukturellen Modifikationen betreffen insbesondere die Substituenten des Chinolin-Ringsystems. Topotecan ist als ein Second-Line-Therapeutikum von Ovarialkarzinomen und des kleinzelligen Bronchialkarzinoms zugelassen. Irinotecan besitzt eine Zulassung als First-Line-Therapeutikum in Kombination mit den Standardtherapeutika 5-Fluoruracil und Folinsäure zur Behandlung des Kolonkarzinoms. Lurtotecan und Exatecan wurden in klinischen der Phasen II und III getestet.
Veresterungen der Hydroxygruppe in Position 20 und Verknüpfung mit Polyethylenglycol (PEG) führen zu Polymerkonjugaten, die zur gezielten Wirkstofffreisetzung am Wirkort (Drug Targeting) eingesetzt werden. Beispiele hierfür sind die in der klinischen Erprobung befindlichen Arzneistoffe Pegamotecan und Protecan.
 Topotecan
Topotecan Irinotecan
Irinotecan Exatecan
Exatecan Lurtotecan
Lurtotecan
Einzelnachweise
- Eintrag zu Camptothecin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juli 2021.
- Datenblatt (S)-(+)-Camptothecin bei Sigma-Aldrich, abgerufen am 15. März 2011 (PDF).
- M. E. Wall, M. C. Wani, C. E. Cook, K. H. Palmer, A. I. McPhail, G. A. Sim: Plant antitumor agents. I. The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from camptotheca acuminate. In: J. Am. Chem. Soc. 88, 1966, S. 3888–3890. doi:10.1021/ja00968a057.
- A. Lorence, C. L. Nessler: Camptothecin, over four decades of surprising findings. In: Phytochemistry. 65, Nr. 20, 2004, S. 2735–2749. doi:10.1016/j.phytochem.2004.09.001. PMID 15474560.
- Y. Yamazaki, M. Kitajima, M. Arita et al.: Biosynthesis of camptothecin. In silico and in vivo tracer study from [1-13C]glucose. In: Plant Physiol. 134, Nr. 1, 2004, S. 161–170. doi:10.1104/pp.103.029389. PMID 14657405. PMC 316296 (freier Volltext).
- D. J. Adams, M. L. Wahl, J. L. Flowers, B. Sen, M. Colvin, M. W. Dewhirst, G. Manikumar, M. C. Wani: Camptothecin analogs with enhanced activity against human breast cancer cells. II. Impact of the tumor pH gradient. In: Cancer Chemotherapy and Pharmacology. 57, Nr. 2, 2005, S. 145–154. doi:10.1007/s00280-005-0008-5.
- M. R. Redinbo, L. Stewart, P. Kuhn, J. J. Champoux, W. G. J. Hol: Crystal structure of human topoisomerase I in covalent and noncovalent complexes with DNA. In: Science. 279, 1998, S. 1504–1513. doi:10.1126/science.279.5356.1504.
- R. P. Verma, C. Hansch: Camptothecins: a SAR/QSAR study. In: Chem. Rev. 109, Nr. 1, 2009, S. 213–235. doi:10.1021/cr0780210.
- Q. Y. Li, Y. G. Zu, R. Z. Shi, L. P. Yao: Review camptothecin: current perspectives. In: Curr. Med. Chem. 13, Nr. 17, 2006, S. 2021–2039. doi:10.2174/092986706777585004. PMID 16842195.
- L. Lesueur-Ginot, D. Demarquay, R. Kiss et al.: Homocamptothecin, an E-ring modified camptothecin with enhanced lactone stability, retains topoisomerase I-targeted activity and antitumor properties. In: Cancer Res.. 59, Nr. 12, 1999, S. 2939–2943. PMID 10383158.