Wilkinson-Katalysator
Der Wilkinson-Katalysator ist ein in der organischen Chemie verwendeter Homogenkatalysator mit der Summenformel C54H45ClP3Rh. Es handelt sich hierbei um einen Rhodiumkomplex, der zur Hydrierung, Hydroformylierung, Hydrosilylierung und zur Isomerisierung von Allylgruppen zu Propenylgruppen Anwendung findet. Der Wilkinson-Katalysator ist nach seinem Entwickler, dem Nobelpreisträger Geoffrey Wilkinson, benannt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
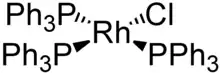 | |||||||||||||||||||
| Ph = Phenyl | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Wilkinson-Katalysator | ||||||||||||||||||
| Andere Namen |
Chloridotris(triphenylphosphin)rhodium(I) (IUPAC) | ||||||||||||||||||
| Summenformel | C54H45ClP3Rh | ||||||||||||||||||
| Kurzbeschreibung |
dunkelroter, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 925,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Struktur und Synthese
Beim Wilkinson-Katalysator handelt es sich um einen quadratisch-planaren Rhodium(I)-komplex, der einen Chlorido- und drei Triphenylphosphan-Liganden (PPh3) trägt. Es handelt sich um einen 16-Valenzelektronenkomplex. Er lässt sich durch Substitution von Triphenylphosphan an Rhodium(III)-chlorid in siedendem Ethanol synthetisieren. Da die Reaktion auch in Mischungen aus Aceton und Wasser statt Ethanol, aber nur in Anwesenheit eines Überschusses von Triphenylphosphan abläuft, ist davon auszugehen, dass letzteres nicht nur als Substituent, sondern auch als Reduktionsmittel fungiert [Reduktion von Rh(III) zu Rh(I)].[2]
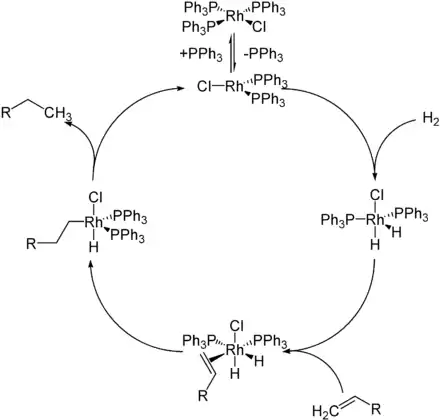
Katalysezyklus
Die Wilkinson-Hydrierung wird zur Hydrierung von Alkenen mit molekularem Wasserstoff genutzt. Entscheidend ist hierbei die Labilität der gebundenen Phosphanliganden, durch deren Abspaltung freie Koordinationsstellen geschaffen werden. Im ersten Schritt spaltet sich ein Phosphanligand vom Katalysator ab. Dann addiert Wasserstoff oxidativ an die zuvor gebildete trigonal-planare 14-Valenzelektronenspezies. Hierbei bildet sich ein trigonal-bipyramidaler Komplex. Die Oxidationsstufe ändert sich von +I auf +III. Das eingesetzte Alken koordiniert dann zunächst side-on am Metall. Anschließend findet die Insertion des Alkens unter Hydrierung statt. Es bildet sich wieder ein trigonal-bipyramidaler Komplex, der nun einen end-on-gebundenen Alkylrest trägt. Die Hydrierung durch den zweiten gebundenen Wasserstoff führt letztlich zur Abspaltung (reduktive Eliminierung) des Alkans unter Rückbildung der Katalysatorspezies.[3]
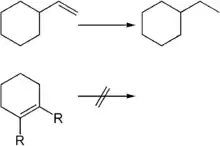
Durch den Wilkinson-Katalysator können selektiv endständige Doppelbindungen hydriert werden. Die Reaktion läuft an diesen so viel schneller ab, dass eine weitere im Molekül vorhandene nicht-endständige Doppelbindung nicht angegriffen wird. Bei sterisch anspruchsvollen Substituenten an der Doppelbindung sowie bei vierfach substituierten Doppelbindungen findet meist überhaupt keine Hydrierung statt.
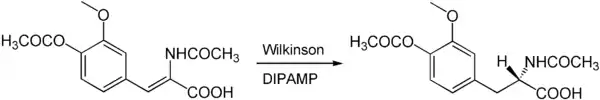
Asymmetrische Hydrierungen
Der Wilkinson-Katalysator kann auch zur asymmetrischen Synthese chiraler Produkte eingesetzt werden. Hierzu werden anstelle der achiralen Triphenylphosphinliganden chirale Phosphine wie beispielsweise DIPAMP oder DIOP verwendet. So kann beispielsweise das Chiralitätszentrum der medizinisch wichtigen Aminosäure L-DOPA über eine asymmetrische Wilkinson-Hydrierung mit DIPAMP als chiralem Ligand aufgebaut werden.[4]
Weblinks
Einzelnachweise
- Eintrag zu Tris(triphenylphosphin)rhodiumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Dezember 2020. (JavaScript erforderlich)
- J. A. Osborn, F. H. Jardine, J. F. Young, G. Wilkinson: The preparation and properties of tris(triphenylphosphine)halogenorhodium(I) and some reactions thereof including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives. In: Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1966, S. 1711–1732, doi:10.1039/J19660001711.
- Beyer/Walter: Lehrbuch der Organischen Chemie. Hirzel Verlag, 23. Auflage. 1998, S. 406f.
- Christen und Fritz Vögtle: Organische Chemie Bd. 2, Otto Salle Verlag, 2. Auflage, 1996, S. 411.