Bromoform
Bromoform (CHBr3) ist ein halogenierter Kohlenwasserstoff. Die Verbindung ist der dreifachsubstituierte Vertreter der Brommethane: Brommethan, Dibrommethan, Tribrommethan und Tetrabrommethan.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
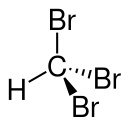 | ||||||||||||||||||||||
| Keilstrichformel zur Verdeutlichung der Geometrie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bromoform | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | CHBr3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, chloroformähnlich riechende Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 252,75 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
2,89 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
149,5 °C[2] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,5948 (25 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 0,5 ml·m−3 bzw. 5 mg·m−3[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−22,3 kJ/mol[6] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Mit seiner Struktur (CHX3) ist es homolog zu Fluoroform, Chloroform und Iodoform und analog benannt.
Vorkommen und Bildung
Bromoform entsteht im Meer aus dessen natürlichem Bromidgehalt durch Algen und andere Meeresorganismen. Es ist damit die stärkste Quelle organischen Broms in der Erdatmosphäre.[7]
Es entsteht ebenfalls bei der Aufbereitung von Wasser für Kühl-, Bade- und Trinkzwecke und ist in allen chlorierten und ozonisierten Wässern enthalten. Küstenkraftwerke, die chloriertes Meerwasser zu Kühlzwecken verwenden, sind dessen stärkste von Menschen erzeugte Quelle.
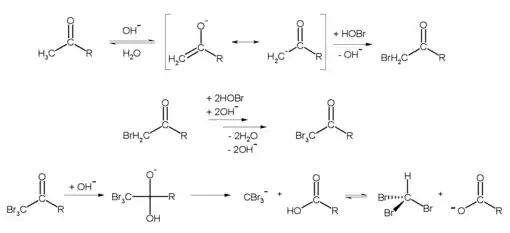
Im Labor kann Bromoform durch die Haloform-Reaktion beispielsweise aus Aceton (R = CH3) und Hypobromit hergestellt werden:[8]
Eigenschaften
Bromoform reagiert mit vielen organischen Verbindungen, wobei giftige Bromverbindungen entstehen können. Mit Alkalimetallen reagiert es explosionsartig. Die Dämpfe sind schwerer als Luft. Beim Erhitzen über den Siedepunkt findet Selbstzersetzung statt.
Atmosphärisches Verhalten
Aus der in der Atmosphäre kurzlebigen Verbindung werden Bromradikale freigesetzt, die für fotochemische Vorgänge in der Troposphäre und Stratosphäre verantwortlich sind. Sie spielen unter anderem eine Rolle bei der Entstehung des Ozonlochs.
Verwendung
Bromoform wurde früher gegen Keuchhusten, als Beruhigungsmittel und zur Trennung von Mineralgemischen verwendet.[8]
Einzelnachweise
- Eintrag zu Haloforme. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Eintrag zu Tribrommethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-490.
- Eintrag zu Bromoform im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-25-2 bzw. Bromoform), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Sanjeevi Rajagopal, Henk A. Jenner, Vayalam P. Venugopalan: Operational and Environmental Consequences of Large Industrial Cooling Water Systems. Springer Science & Business Media, 2012, ISBN 978-1-4614-1697-5, S. 211 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jürgen Falbe, Manfred Regitz: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999 Band 1: A - Cl. Georg Thieme Verlag, 2014, ISBN 3-13-199951-9, S. 525 (eingeschränkte Vorschau in der Google-Buchsuche).

