Antiaromat
In der Chemie werden Verbindungen, die das Phänomen der Antiaromatizität zeigen, als Antiaromaten bezeichnet. Bei Antiaromaten führt die cyclische Delokalisation von 4n Elektronen (n = 1, 2, 3 …) zu einer energetischen Destabilisierung (Hückel-Regel). Dies steht im genauen Gegensatz zu den Aromaten, bei denen die cyclische Delokalisation von 4n + 2 Elektronen zu einer energetischen Stabilisierung führt (Hückel-Regel, vertiefte Diskussion siehe Aromatizität). Mit der energetischen Destabilisierung geht bei den Antiaromaten eine erhöhte Reaktivität einher.
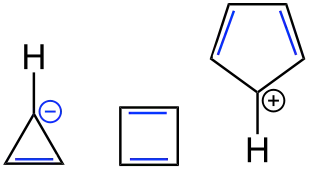
Grundsätzlich werden die Phänomene Aromatizität und Antiaromatizität in organischen und in anorganischen Systemen angetroffen. In der Organischen Chemie werden sie meist an planaren, cyclischen Kohlenwasserstoffverbindungen mit konjugierten Doppelbindungen diskutiert. Antiaromaten weisen dann 4n π-Elektronen auf.[2] Um der energetisch ungünstigen Situation zu entgehen, werden zum einen Konformationen eingenommen, in denen die cyclische Delokalisation so weit wie möglich vermindert ist, zum anderen erfolgen Reaktionen, bei denen die cyclische Konjugation aufgehoben wird. Für perfekt cyclisch delokalisierte antiaromatische Systeme sagt die Hückel-Regel eine Diradikalstruktur (Triplett) voraus, aus welcher sich die hohe Reaktivität der Antiaromaten zwanglos erklären lässt.
Paradebeispiel für eine antiaromatische Verbindung ist das Cyclobutadien, das nur bei sehr tiefer Temperatur (≤ 20 K) in einer festen Matrix beständig ist. Tri-tert-butylcyclopentadien ist hingegen einige Stunden bei 20 °C beständig (sterische Abschirmung). Der Komplex Cyclopentadien-eisentricarbonyl ist bei Raumtemperatur beständig und dient als Quelle zur Erzeugung von Cyclopentadien.[3]
Einzelnachweise
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 425, ISBN 978-3-11-024894-4.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 73, ISBN 3-342-00280-8.
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 426, ISBN 978-3-11-024894-4.