Glycidol
Glycidol ist eine organische chemische Verbindung aus den Gruppen der Epoxide (Oxirane) und der Alkohole. Die Substanz ist eine klare, geruch- und geschmacklose Flüssigkeit, die langsam mit Wasser zu Glycerin reagiert. Das Glycidolmolekül ist chiral und kommt daher in zwei verschiedenen, spiegelbildlichen Enantiomeren vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
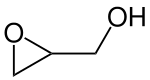 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycidol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 74,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,1143 g·cm−3 (Racemat)[2] | ||||||||||||||||||
| Schmelzpunkt |
−54 °C[1] | ||||||||||||||||||
| Siedepunkt |
161 °C (Zersetzung)[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,433 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Physikalische Eigenschaften
Der Drehwert für unverdünntes (R)-(+)-Glycidol bei 23 °C (Natrium-D-Linie) beträgt +15°.[7]
Herstellung
Racemisches Glycidol lässt sich durch Dehalogenierung und Epoxidbildung aus 3-Chlor-1,2-propandiol mit Basen gewinnen.
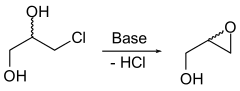
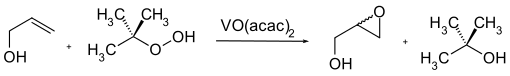
Aus Allylalkohol und tert-Butylhydroperoxid und in Anwesenheit von katalytischen Mengen Vanadium(IV)-oxy(acetylacetonat) (VO(acac)2) lässt sich ebenfalls Glycidol synthetisieren.[8]
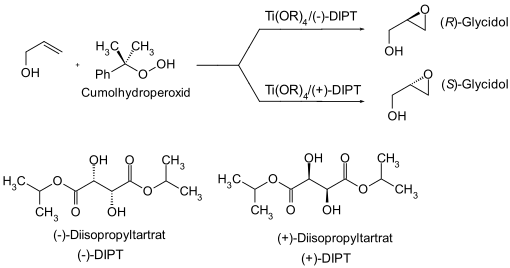
Ebenfalls durch Oxidation von Allylalkohol mit Cumolhydroperoxid lässt sich in einer Sharpless-Epoxidierung stereospezifisch in Anwesenheit von Titantetraethanolat oder Titantetraisopropanolat und Diethyltartrat als chirales Auxiliar selektiv das (R)- oder das (S)-Enantiomer darstellen.[9][8]
Reaktionen
Durch Reaktion der Epoxigruppe kann Glycidol eine Vielzahl von Reaktionen mit Nukleophilen eingehen. Mit Alkoholen bilden sich über Ringöffnung Ether. Über die OH-Gruppe können sowohl Ester als auch Ether entstehen.
Verwendung
Glycidol wird als Stabilisator für Pflanzenöle und Vinyl-Polymere und zur Entmischung von Emulsionen eingesetzt.[10] Weiterhin dient es zur Herstellung von Tensiden, Arzneimitteln, Kunstharzen und Ausrüstungsmitteln für Textilien. Auf Glycidol basierende Ether und Ester kommen als Epoxidharze sowie als Reaktivverdünner in Lacken, Klebstoffen und Beschichtungen zum Einsatz.
Sicherheitshinweise
In Gegenwart geeigneter Katalysatoren kann Glycidol explosionsartig polymerisieren. Der Stoff ist krebserregend, reizt stark die Schleimhäute und die Haut und verursacht bei Kontakt durch Verletzung der Hornhaut schwere Augenschäden. Das zentrale Nervensystem kann stimuliert werden, bei anschließender möglicher Depression. Im Tierversuch mit Ratten und Mäusen erwies sich Glycidol als genotoxisch, carcinogen und erzeugte verringerte Fertilität bis hin zur Sterilität.[11]
In Baden-Württemberg wurden in pflanzlichen Speiseölen wie Palmöl Glycidol-Fettsäureester gefunden, die bei der Raffination entstehen können. Diese Ester hydrolysieren im menschlichen Verdauungstrakt zu Fettsäuren und Glycidol. Deshalb rät das BfR von der Verwendung von Palmöl-haltiger Babynahrung ab.[12]
Literatur
- Beilsteins Handbuch der Organischen Chemie E, III/IV, 17: 985.
Weblinks
Einzelnachweise
- Eintrag zu 2,3-Epoxy-1-propanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006, ISBN 978-0-911910-00-1; S. 775–776.
- David R. Lide: CRC Handbook of Chemistry and Physics. 85. Auflage, 2005, CRC Press, Kap. 3, S. 444.
- Eintrag zu Glycidol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- Datenblatt Glycidol bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- Eintrag zu 2,3-epoxypropan-1-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt (R)-(+)-Glycidol 97% bei Sigma-Aldrich, abgerufen am 18. Januar 2013 (PDF).
- Joachim Buddrus: In Grundlagen der Organischen Chemie, S. 184–185, 4. Auflage. Walter de Gruyter GmbH & Co. KG Berlin/New York 2011, ISBN 3-11-024894-8.
- Leo A. Paquette: Handbook of Reagents for Organic Synthesis: Chiral reagents for asymmetric synthesis.John Wiley and Sons, 2003, ISBN 978-0-470-85625-3, S. 345.
- Jeffrey W. Vincoli: Risk management for hazardous chemicals. Band 2, CRC Press, 1997, ISBN 978-1-56670-200-3, S. 1563.
- BauA: 2,3-Epoxypropan-1-ol (Glycidol), 15. Mai 2002.
- Fragen und Antworten zu Glycidol-Fettsäureestern FAQ des BfR vom 30. April 2009.

