Gentisinsäure
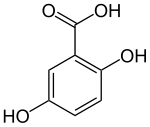
Gentisinsäure (2,5-Dihydroxybenzoesäure) ist eine aromatische Verbindung, die sich formal sowohl von der Benzoesäure als auch vom Hydrochinon (1,4-Dihydroxybenzol) ableitet. Die Struktur besteht aus einem Benzolring mit einer Carboxygruppe (–COOH) und zwei Hydroxygruppen (–OH) als Substituenten. Sie gehört zur Gruppe der Dihydroxybenzoesäuren und kommt in einigen Pflanzen wie Kümmel und Lavendel sowie Enzian (wiss. Name Gentiana) vor.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Gentisinsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H6O4 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber, geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 154,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert |
2,95 (COOH)[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Gentisinsäure ist ein Nebenprodukt (1 %) beim Metabolismus der Acetylsalicylsäure, das von den Nieren ausgeschieden wird.[7]
Darstellung
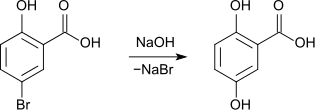
Historisch wurde Gentisinsäure aus 5-Bromsalicylsäure durch Schmelzen mit Natriumhydroxid hergestellt.[8]
Weiters gelang 1881 Ferdinand Tiemann die Darstellung durch das Schmelzen von Kaliumhydroxid mit Gentisinaldehyd, der aus Hydrochinon und Chloroform in Gegenwart von Natronlauge hergestellt wurde.[9]
Gentisinsäure wird durch Carboxylierung von Hydrochinon mittels Kolbe-Schmitt-Reaktion hergestellt.[10]
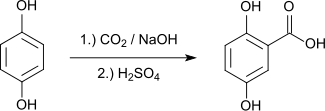
Die Synthese gelingt auch bei Atmosphärendruck durch Kochen von Hydrochinon mit Tetrachlorkohlenstoff und Kupferpulver. Tetrachlormethan ist redoxäquivalent zu Kohlenstoffdioxid.[11]
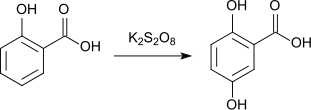
Auch bei der Oxidation von Salicylsäure mit Kaliumpersulfat[12] entsteht in Gegenwart von Eisen(II)-sulfat Gentisinsäure.[13]
Reaktionen
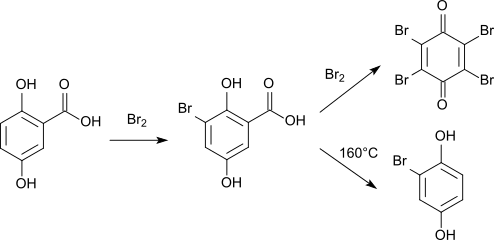
Direkte Bromierung von Gentisinsäure liefert 3-Bromgentisinsäure.[14][15] Ein Überschuss von Brom führt zur Eliminierung der Carboxygruppe, es entsteht Bromanil (2,3,5,6-Tetrabrom-1,4-benzochinon).[16] Beim Erhitzen der Bromgentisinsäure auf 160 °C in Gegenwart von Wasser entsteht Bromhydrochinon.[16]
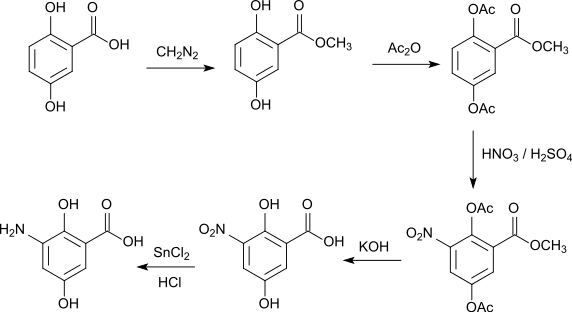
Acetylierung mit Essigsäureanhydrid liefert die Diacetylgentisinsäure, die bei 118–119 °C schmilzt.[16] Mit Diazomethan kann der Methylester hergestellt werden.[17] Die direkte Nitrierung von Gentisinsäure ist nur mit geringen Ausbeuten mit stark verdünnter Salpetersäure möglich, es findet hauptsächlich eine Oxidation unter Bildung von Oxalsäure statt.[16] Ebenso misslingt die direkte Nitrierung des Diacetylderivates.[16] Die Synthese von 3-Nitrogentisinsäure kann jedoch über den Methylester der Diacetylgentisinsäure erfolgen.[17] Durch Reduktion mit Zinn(II)-chlorid und Salzsäure entsteht aus 3-Nitrogentisinsäure die 3-Aminogentisinsäure.[18]
Wie die meisten Hydrochinonderivate kann Gentisinsäure leicht oxidiert werden.
Verwendung
Gentisinsäure wird als Zwischenprodukt bei der Herstellung von Pharmazeutika (besonders Analgetika und Antirheumatika) und anderen organischen Verbindungen verwendet.
Sie wird bei der MALDI-TOF-Analytik als Matrix zur Ionisation von Peptiden, Proteinen und Kohlenhydraten angewendet.[19] Sie kann als Reagens zur Detektion von Borsäure in Peptiden eingesetzt werden.[20]
Außerdem wird sie in der Medizin als Glucosamid (Amid von Glucosamin) zur parenteralen Anwendung verwendet. Gentisinsäure hemmt, ebenso wie Salicylsäure, die Prostaglandinsynthese und wurde daher früher als Antirheumatikum verwendet.[6]
Natriumgentisat wird als Medikament gegen rheumatisches Fieber eingesetzt.[21][22] Zink- und Mangangentisat können als Katalysatoren für die Polyesterbildung verwendet werden.[23] 2-Aminogentisinsäure hat antibiotische Eigenschaften gegenüber grampositiven und gramnegativen Bakterien.[24]
Weblinks
2,5-Dihydroxybenzoesäure
- Beilstein (Syst.Nr. 1105), Band. 10:
Einzelnachweise
- Eintrag zu 2,5-DIHYDROXYBENZOIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. Mai 2020.
- Datenblatt Gentisinsäure (PDF) bei Merck, abgerufen am 18. Januar 2011.
- Eintrag zu Gentisic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 3-11-011451-8, S. 449 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt 2,5-Dihydroxybenzoic acid bei Sigma-Aldrich, abgerufen am 14. Mai 2017 (PDF).
- Eintrag zu Gentisinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- G. Levy, T. Tsuchiya: Salicylate Accumulation Kinetics in Man. In: New England Journal of Medicine. 287, Nr. 9, 1972, S. 430–432, doi:10.1056/NEJM197208312870903.
- P. v. Rakowski, W. Leppert: Ueber Hydrochinoncarbonsäure. In: Berichte der deutschen chemischen Gesellschaft, 8, Nr. 1, 1875, S. 788–790; doi:10.1002/cber.187500801256, gallica.bnf.fr.
- F. Tiemann, M. Müller: Ueber Abkömmlinge des Hydrochinons . In: Berichte der deutschen chemischen Gesellschaft, 1881, 14, S. 1985–1999 gallica.bnf.fr.
- P. M. Hudnall: Hydroquinone. In Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002, doi:10.1002/14356007.a13_499.
- J. Zeltner, Max Landau "Verfahren zur Darstellung von Phenolcarbonsäuren", DE 258887, angemeldet 10. Januar 1912.
- M. B. Fawzi: Gentisic acid salts as radiographic scanning agent stabilizers. US Patent 4497744, angemeldet 3. November 1980.
- S. G. Morris: Preparation of Gentisic Acid and its Fatty Alcohol Esters in J. Am. Chem. Soc. 71, Nr. 6, 1949, S. 2056–2057, doi:10.1021/ja01174a046.
- R. L. Crawford, S. W. Hutton, P. J. Chapman: Purification and Properties of Gentisate 1,2-Dioxygenase from Moraxella osloensis. In: Journal of Bacteriology. 121, Nr. 3, 1975, S. 794–799; PMC 246005 (freier Volltext).
- M. C. Kloetzel, B. Y. Abadir: Synthetic Analogs of Cortical Hormones. II. 3-Substituted a-2,5-Trihydroxyacetophenone Derivatives. In: J. Am. Chem. Soc. 77, Nr. 14, 1955, S. 3823–3826, doi:10.1021/ja01619a043.
- F. v. Hemmelmayr: Zur Kenntnis der Gentisinsäure (2, 5-Dioxybenzencarbonsäure (1)) und einiger ihrer Derivate. In: Monatshefte für Chemie. 30, Nr. 3, 1909, S. 255–269, doi:10.1007/BF01519683.
- A. Klemenc: Über Nitrogentisinsäuren. In: Monatshefte für Chemie. 1912, 33, S. 1243–1254, doi:10.1007/BF01518823.
- F. v. Hemmelmayr: Über einige neue Derivate von Di- und Trioxybenzoesäuren. In: Monatshefte für Chemie. 1914, 35, S. 1–8, doi:10.1007/BF01519727.
- K. Strupat, M. Karas, F. Hillenkamp: 2,5-Dihydroxybenzoic acid: a new matrix for laser desorption—ionization mass spectrometry. In: International Journal of Mass Spectrometry and Ion Processes. 1991, 111, S. 89–102, doi:10.1016/0168-1176(91)85050-V.
- J. B. Crumpton, W. Zhang, W. L. Santos: Facile Analysis and Sequencing of Linear and Branched Peptide Boronic Acids by MALDI Mass Spectrometry. In: Analytical Chemistry. 83, Nr. 9, 2011, S. 3548–3554, doi:10.1021/ac2002565.
- B. W. Meade, M. J. H. Smith: The estimation of Sodium Gentisate in Plasma and Urine. In: Journal of Clinical Pathology, 1951, 4, S. 226; PMC 1023403 (freier Volltext).
- L. E. Schaefer, I. A. Rashkoff, R. S. Megibow: Sodium Gentisate in the Treatment of Acute Rheumatic Fever (PDF; 1,2 MB). In: Circulation, 1950, 2, S. 265–270.
- J. A. Price: Zinc and manganese gentisate as polyester catalysts and molecular weight enhancer. US Patent Nr. 3673157n angemeldet 31. Juli 1970.
- A. Zeeck, S. Breiding-Mack, S. Grabley, H. Voelskow, G. Seibert (Hoechst AG): Gentisic acid derivatives having antibiotic activity. US Patent 4861796, angemeldet 19. Dezember 1988.