1,3-Pentadien
1,3-Pentadien ist eine unpräzise Bezeichnung für zwei chemische Verbindungen aus der Gruppe der Diene, die zueinander isomer (Konfigurationsisomere) sind. Es wird auch als Piperylen (als Ableitung von Piperin[4]) bezeichnet.
| 1,3-Pentadiene (Penta-1,3-diene, Piperylene, 1-Methyl-1,3-butadiene) | |||||||
| Name | trans-1,3-Pentadien | cis-1,3-Pentadien | |||||
| Andere Namen | trans-Penta-1,3-dien (E)-1,3-Pentadien trans-Piperylen (E)-Piperylen |
cis-Penta-1,3-dien (Z)-1,3-Pentadien cis-Piperylen (Z)-Piperylen | |||||
| Strukturformel | 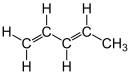 | 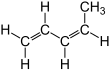 | |||||
| CAS-Nummer | 2004-70-8 | 1574-41-0 | |||||
| 504-60-9 (Isomerengemisch) | |||||||
| PubChem | 62204 | 643785 | |||||
| Summenformel | C5H8 | ||||||
| Molare Masse | 68,12 g·mol−1 | ||||||
| Aggregatzustand | flüssig | ||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | ||||||
| Schmelzpunkt | −87 °C[1] | −141 °C[2] | |||||
| Siedepunkt | 42 °C[1] | 44 °C[2] | |||||
| Dichte | 0,683 g·cm−3 (25 °C)[1] | 0,691 g·cm−3 (25 °C)[2] | |||||
| Dampfdruck | 452 hPa (20 °C)[1] | 453 hPa (20 °C)[2] | |||||
| Brechungsindex | 1,430 (20 °C)[1] | 1,437 (20 °C)[2] | |||||
| Löslichkeit | mischbar mit Ethanol, Ether, Aceton und Benzol[3] | ||||||
| GHS- Kennzeichnung |
|
| |||||
| H- und P-Sätze | 225‐304‐315‐319‐335 | 225‐304 | |||||
| keine EUH-Sätze | keine EUH-Sätze | ||||||
| 210‐261‐301+310‐305+351+338‐331 | 210‐301+310‐331 | ||||||
Ein weiteres 1,3-Pentadien ist das verzweigte Isomer 2-Methylbutadien (Isopren).
Gewinnung und Darstellung
1,3-Pentadien kann durch Methylierung von 1,3-Butadien mit Dimethylsulfoxid in Gegenwart einer Base wie Kalium-tert-butoxid gewonnen werden, wobei ein Gemisch aus etwa 80 % trans- und 20 % cis-1,3-Pentadien entsteht.[3]
Die Herstellung kann auch durch eine Wittig-Reaktion aus Acetaldehyd, Acrolein oder Crotonaldehyd erfolgen, wobei sowohl die Ausbeute als auch die cis/trans-Selektivität in Abhängigkeit von verschiedenen Faktoren (z. B. dem Ausgangsstoff oder dem verwendeten Lösungsmittel) variiert.[5]
Es entsteht ebenfalls bei der Hofmann-Eliminierung aus Piperidin, welches durch wiederholte erschöpfende Methylierung und darauf folgende Eliminierung von Trimethylamin in 1,4-Pentadien umgewandelt wird, das aber unter den Reaktionsbedingungen zum 1,3-Pentadien isomeriert.[6]
Es entsteht auch als Nebenprodukt des Trennprozesses von rohen C5-Materialien von Pyrolysebenzin (Pygas) – beide Nebenprodukte der Herstellung von Ethylen.[7]
Eigenschaften
1,3-Pentadien ist eine farblose Flüssigkeit.[1]
Verwendung
1,3-Pentadien kann zur Herstellung anderer chemischer Verbindungen wie z. B. 2-Methylfuran verwendet werden. Es dient auch als Monomer bei der Herstellung von Kunststoffen, Klebstoffen und Harzen. Piperylen-basierte Produkte werden insbesondere in modernen Klebstoffen – wie bei der Herstellung von Briefumschlägen, Paketband und Windelbefestigungen – sowie weltweit in Fahrbahnmarkierungen verwendet.[7]
Einzelnachweise
- Datenblatt trans-1,3-Pentadiene, 90% bei Sigma-Aldrich, abgerufen am 13. Oktober 2012 (PDF).
- Datenblatt cis-1,3-Pentadiene, 98% bei Sigma-Aldrich, abgerufen am 13. Oktober 2012 (PDF).
- Eintrag zu trans-1,3-Pentadiene in der Hazardous Substances Data Bank, abgerufen am 13. Oktober 2012 (online auf PubChem).
- C. Schotten: Beitrag zur Kenntniss des Piperidins. In: Berichte der deutschen chemischen Gesellschaft 15, 1882, S. 421–427, doi:10.1002/cber.18820150186.
- Jerome Thomas Kresse: The investigation of factors influencing the stereochemistry of the Wittig reaction (PDF; 3,9 MB), University of Florida, Diss., 1965.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. John Wiley & Sons, 2003, ISBN 3-906390-29-2, S. 255 (eingeschränkte Vorschau in der Google-Buchsuche).
- Shell Chemicals: Piperylene product overview (Memento vom 18. September 2013 im Internet Archive).


