Spannungsenergie
Unter Spannungsenergie wird die Abweichung der Enthalpiekomponente der Gibbs-Energie eines in einem Spannungszustand befindliche Moleküls im Vergleich zum Grundzustand verstanden. Das Konzept ist ein Leitmotiv in der Chemie alicyclischer Kohlenwasserstoffe. Es hat keine quantenchemische Grundlage, sondern basiert auf „mechanischen“ Modellbetrachtungen (Kraftfeld-Rechnungen), welche später als Molekulare Mechanik weiterentwickelt wurden.
Geschichte
Historisch klingt das Motiv im Jahre 1885 an, mit der Betrachtung der Cycloalkane durch Adolf von Baeyer: Kohlenwasserstoffe, deren C-C-C-Bindungswinkel (Valenzwinkel) vom Winkel eines Tetraeders (109° 28′) abweichen, sollten „gespannt“ sein.[1] Da der dreidimensionale Aufbau der meisten Moleküle (Stereochemie) damals nicht erkannt wurde, ging Baeyer davon aus, dass die Kohlenstoffatome monocyclischer Kohlenwasserstoffe in einer Ebene liegen würden. Die Energie, welche bei einer Veränderung des „idealen“ Tetraederwinkels aufgewendet werden muss, wird heute als Winkelspannung oder Baeyer-Spannung bezeichnet. Allerdings sollte bei der Betrachtung der Winkelspannung davon ausgegangen werden, dass ein Winkel von 109° 28‘ nur bei tetraedrisch konfigurierten Molekülen mit vier gleichen Substituenten erwartet werden kann (z. B. Methan, Tetrachlormethan). In unverzweigten Alkanen und Cycloalkanen sind jedoch die Liganden am C-Atom nicht identisch; zwei davon sind C-Atome, zwei sind H-Atome. Wie zahlreiche Strukturanalysen zeigten, haben „spannungsfreie“ Kohlenwasserstoffe eher einen Valenzwinkel von ca. 112° (Propan: 112,4°, Cyclohexan: 111,4°). Von diesen Werten sollte also ausgegangen werden, wenn man Vergleiche von Verbindungen anstellt.
Später wurde erkannt, dass es noch weitere Ursachen für Spannungen in organischen Molekülen gibt:
- Bindungsspannung (engl. bond strain)
Ändert sich der Abstand der Atomkerne im Vergleich zur Standardbindungslänge (für C-C 153 pm), so ändert sich auch die Bindungsenergie.
- Torsionsspannung (Pitzer-Spannung), engl. torsional strain, Pitzer strain
Wird der bei der „gestaffelten“ Konformation günstigste Torsionswinkel von 60° verändert, so ändert sich die Konformationsenergie.
- Van-der-Waals-Spannung (Nichtbindende Wechselwirkungen)
Kommen sich die Elektronenwolken von Wasserstoffatomen in C-H-Bindungen zu nahe, führt dies zu einer Erhöhung der inneren Energie des Moleküls. Dieses Phänomen wird als nichtbindende Wechselwirkung (engl. non-bonded interaction) bezeichnet. Da es vor allem bei mittelgroßen Kohlenstoffringen beobachtet wurde, ist für diesen Fall die Bezeichnung transannulare Spannung (Prelog-Spannung) gewählt worden.
Energieanteile
Spannungsenergie (engl. strain energy) kann als Summe dieser Energieanteile aufgefasst werden, d. h., sie lässt sich in einzelne Beiträge zerlegen.
EB = Bindungsspannung, EW = Winkelspannung, ETors = Torsionsspannung, Enb = nichtbindende Wechselwirkungen.
Als Energiegröße wird Spannungsenergie in kJ/mol (veraltet: kcal/mol) angegeben. Sie manifestiert sich in der Reaktionsenthalpie der Kohlenwasserstoffe. Diese wird mit einem (hypothetischen) Standard ohne Spannung verglichen, d. h. man benötigt ein Referenzsystem. So wird die Spannungsenergie (SE) definiert als Differenz von experimentell ermittelter Bildungsenthalpie und berechneter Bildungsenthalpie:
Im Laufe der Zeit sind mehrere Referenzsysteme entwickelt worden (siehe unten). Daher gibt es verschiedene Zahlenwerte für Spannungsenergien.
Beispiele
Cycloalkane
Aus den Verbrennungswärmen von unverzweigten, also „spannungsfreien“ Alkanen lässt sich ableiten, dass sich die Bildungsenthalpie um minus 20,63 kJ·mol−1 ändert, wenn man den Kohlenwasserstoff um eine Methylengruppe (CH2) verlängert. Multipliziert man diesen Wert mit der Zahl der C-Atome in einem Cycloalkan, so ergibt sich die berechnete Bildungsenthalpie.
| Cycloalkan | n | ΔHf0(exp)[2] | ΔHf0(exp) | ΔHf0(ber) | SE (Benson) | SE (Benson) | SE (Schleyer) | SE (Schleyer) |
|---|---|---|---|---|---|---|---|---|
| (CH2)n | kJ·mol−1 | kcal·mol−1 | kcal·mol−1 | kcal·mol−1 | kJ·mol−1 | kcal·mol−1 | kJ·mol−1 | |
| Cyclopropan | 3 | +53,3 | 12,7 | −14,8 | 27,5 | 115,2 | 28,1 | 117,7 |
| Cyclobutan | 4 | +28,4 | 6,8 | −19,7 | 26,1 | 110,9 | 27,3 | 114,2 |
| Cyclopentan | 5 | −76,4 | −18,3 | −24,6 | 6,3 | 26,7 | 7,4 | 30,9 |
| Cyclohexan | 6 | −123,4 | −29,5 | −29,6 | 0 | 0,4 | 1,3 | 5,4 |
| Cycloheptan | 7 | −118,1 | −28,2 | −34,5 | 6,3 | 26,3 | 7,7 | 32,1 |
| Cyclooctan | 8 | −124,4 | −29,7 | −39,4 | 9,7 | 40,6 | 11,3 | 47,3 |
| Cyclononan | 9 | −132,8 | −31,7 | −44,4 | 12,7 | 52,8 | 14,4 | 60,4 |
| Cyclodecan | 10 | −154,3 | −36,9 | −49,3 | 12,4 | 52,0 | 14,4 | 60,3 |
| Cycloundecan | 11 | −179,4 | −42,9 | −54,2 | 11,3 | 47,5 | 13,5 | 56,7 |
| Cyclododecan | 12 | −230,2 | −55,0 | −59,2 | 4,2 | 17,3 | 6,5 | 27,3 |
| Cyclotridecan | 13 | −246,4 | −58,9 | −64,1 | 5,2 | 21,8 | 7,8 | 32,6 |
| Cyclotetradecan | 14 | −239,2 | −57,2 | −69,0 | 11,8 | 49,6 | 14,6 | 61,3 |
Der oben genannte Wert kann als Inkrement für eine CH2-Gruppe definiert werden. Ebenso lassen sich Inkremente für primäre (CH3-Gruppe), tertiäre und quartäre Kohlenstoffatome („Bausteine“) definieren. So erhält man Systeme, die geeignet sind, durch Summation von Gruppeninkrementen oder Bindungsinkrementen Bildungsenthalpien zu berechnen, besser: abzuschätzen. Klages,[3] Laidler,[4] Benson[5] (siehe Artikel Benson-Methode) und Paul von Ragué Schleyer[6] haben häufig verwendete Inkrementsysteme entwickelt.
Schleyer bevorzugte für das Inkrement der CH2-Gruppe den Wert −21,46 kJ·mol−1, der sich auf Alkane in der all-anti-Konformation bezieht. Hier liegt für alle C-Atome der günstigste Torsionswinkel 180° vor, so dass die Kette der Kohlenstoffatome als Zickzack-Linie in die Ebene projiziert werden kann. Der Wert −20,61 kJ·mol−1 wurde von Alkanen abgeleitet, welche als Konformerengemische vorliegen, d. h., die neben der all-anti-Konformation noch gestaffelte (gauche) Konformere enthalten. Die Spannungsenergien werden dadurch höher.
Nachdem in die Chemie Computer eingezogen waren, konnten Bildungsenthalpien und Spannungsenergien auch durch die Modelle der Molekularen Mechanik berechnet werden.
Verzweigte Alkane
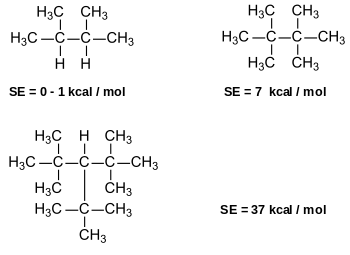
Einige Alkane weisen erhebliche Spannungsenergien auf, z. B. 2,2,3,3-Tetramethylbutan und Tris-tert-butylmethan (systematischer Name: 3-(1,1-Dimethylethyl)-2,2,4,4-tetramethylpentan), (SE = 37,1 kcal mol−1).[7] Dagegen ist 2,3-Dimethylbutan ohne Spannung; die Methylgruppen können in eine gestaffelte Position (Torsionswinkel 60°) ausweichen.
Polycyclische Kohlenwasserstoffe
Viele Bicycloalkane sind gespannt, vor allem die anellierten Cyclobutane und Cyclopropane, d. h. Bicyclo[m.2.0]- und [m.1.0]alkane. Unter den Bicycloalkanen hält Bicyclo[1.1.0]butan den Rekord an Spannungsenergie (267,1 kJ·mol−1).
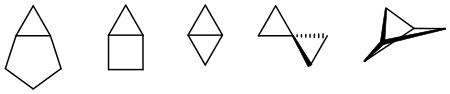
In der zweiten Hälfte des 20. Jahrhunderts wetteiferten organische Chemiker in der Synthese polycyclischer Kohlenwasserstoffe, die man früher wegen ihrer Spannung für „unmöglich“ gehalten hätte. Spektakuläre Ereignisse waren die Synthesen von Cuban, Bicyclo[1.1.1]pentan, Tetrahedranen und Rotanen. Spiropentan wurde schon im Jahr 1896 synthetisiert.
Die Spannungsenergie beschreibt zunächst den Energieinhalt eines Moleküls (Kohlenwasserstoffs). In der chemischen Reaktivität wird sie vor allem wirksam bei Thermolysen (Pyrolysen), die mit einer homolytischen Spaltung von C-C-Bindungen beginnen. Beispiele werden in einigen Artikeln über einzelne Kohlenwasserstoffe besprochen.
Siehe auch
Einzelnachweise
- Adolf Bayer: In: Berichte der Deutschen Chemischen Gesellschaft. 18 (1885), S. 2269.
- Daten aus: J.B. Pedley, R. D. Naylor, S. P. Kirby, Thermochemical Data of Organic Compounds, 2. Aufl., Chapman and Hall, London, New York, 1986. ISBN 0-412-27100-1
- Friedrich Klages: Über eine Verbesserung der additiven Berechnung von Verbrennungswärmen und der Berechnung der Mesomerie-Energie aus Verbrennungswärmen. In: Chem. Ber. 82 (1949), S. 358–375, doi:10.1002/cber.19490820411.
- Keith J. Laidler: A System of Molecular Thermochemistry for Organic Gases and Liquids. In: Canadian Journal of Chemistry. 34, 1956, S. 626–648, doi:10.1139/v56-086.
- Sidney W. Benson: Thermochemical Kinetics. 2. Auflage. Wiley, New York 1976, ISBN 0-471-06781-4.
- P. v. R. Schleyer, J. E. Williams, K. R. Blanchard: In: J. Am. Chem. Soc. 92 (1970), S. 2377.
- M. A. Flamm-Ter Meer, H.-D. Beckhaus, C. Rüchardt, Thermolabile Kohlenwasserstoffe. XXIX.: Verbrennungsenthalpie und Sublimationsenthalpie von Tri-tert-butylmethan, Thermochimica Acta, Bd. 10 (1986), S. 331–338, ISSN 0040-6031, doi:10.1016/0040-6031(86)85059-6.
Literatur
- Thomas H. Lowry, Kathleen S. Richardson: Mechanismen und Theorie in der Organischen Chemie. 1. Auflage. Verlag Chemie, Weinheim 1980, ISBN 3-527-25795-0, S. 17–33.
- J. D. Cox, G. Pilcher: Thermochemistry of Organic and Organometallic Compounds. Academic Press, New York 1970, ISBN 0-12-194350-X.
- Sidney W. Benson: Thermochemical Kinetics. 2. Auflage. Wiley, New York 1976, ISBN 0-471-06781-4.
- Armin de Meijere: Sport, Spiel, Spannung – die Chemie der kleinen Ringe. In: Chemie in unserer Zeit. 16, 13 (1982).