Faworski-Umlagerung
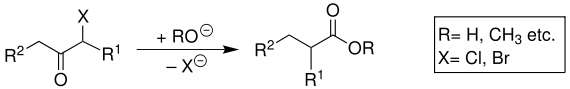
Die Faworski-Umlagerung (oft Favorskii-Umlagerung geschrieben, englisch Favorskii rearrangement) ist eine Namensreaktion in der organischen Synthesechemie, die nach dem russischen Chemiker Alexei Jewgrafowitsch Faworski (1860–1945) benannt wurde.[1] Die Faworski-Umlagerung in ihrer einfachsten Form beschreibt die Umlagerung von enolisierbaren α-Halogenketonen zu Carbonsäuren unter Zugabe von Hydroxiden (starker Basen). Durch Variation der verwendeten Base sind auch Carbonsäureester und Carbonsäureamide zugänglich.[2]
Die Faworski-Umlagerung sollte nicht mit der Faworski-Reaktion verwechselt werden.
Historie
Die Faworski-Umlagerung von α-Halogenketonen im basischen Milieu führt zu Carbonsäuren oder Carbonsäureestern. Ausgangssubstanzen meist Chlor- oder Bromketone, selten Iodketone. Geeignete Basen sind Hydroxide, Alkoholate und Amine. Mit Ammoniak können Carbonsäureamide entstehen.
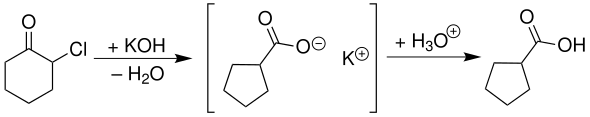
α-Chlorcyclohexanon liefert mit Kalilauge unter Ringverengung das Kaliumsalz der Cyclopentancarbonsäure, das durch Neutralisation zu Cyclopentancarbonsäure umgesetzt werden kann:[3]
Faworski erkannte, dass beim Behandeln einiger aliphatischer Dihalogenketone des Typs RCH2CX2COCH2R’ mit verdünnter Kalilauge α,β-ungesättigte Carbonsäuren entstehen.[1]
Reaktionsmechanismus
Der genaue Ablauf der nach Faworski benannten Umlagerungen war lange Zeit umstritten. Schließlich wurde erkannt, dass mindestens zwei Mechanismen möglich sind. Sodass heute zwischen Faworski-Umlagerung und Quasi-Faworski-Umlagerung (englisch quasi-Favorskii rearrangement) unterschieden wird.[4]
Der Mechanismus der Faworski-Umlagerung beginnt mit der Deprotonierung des α-Halogenketons 1 durch die verwendete Base. Dabei bildet sich das durch Keto-Enol-Tautomerie stabilisierte Carbanion 2, welches nach der Abspaltung des Halogenidions in das Cyclopropanon-Intermediat 3 übergeht. Das positiv polarisierte Kohlenstoffatom der Carbonylgruppe wird dann nucleophil durch die verwendete Base angegriffen. Es entsteht die Verbindung 4, die nach einer Umlagerung durch ein Wassermolekül protoniert wird. Es entsteht die gewünschte Verbindung 6.
Wird 1 mit Kali- oder Natronlauge umgesetzt, so entsteht eine Carbonsäure (R = H). Setzt man hingegen 1 mit einem Alkoholat um, ist das Reaktionsprodukt 6 ein Carbonsäureester 6 (R = Organyl-Rest, wie z. B. Alkyl-Rest) und bei Verwendung von Aminen wird ein Carbonsäureamid erhalten.[5][6]

Ein Beispiel für den Mechanismus ist die Reaktion des α-Chlorcyclohexanons 7. Auch hier tritt eine Zwischenstufe der Cyclopropanon-Struktur 8 auf, wie Loftfield durch Markierung mit 14C bewies.[5]

Quasi-Faworski-Umlagerung
Bei nicht enolisierbaren (oder nur äußerst langsam enolisierbaren) α-Halogenketonen findet ein anderer Mechanismus statt. Dies kann der Fall sein, wenn keine α-Wasserstoffatome vorliegen[7] oder sich aufgrund von Ringspannung nur schwer eine für die Enol-Form entscheidende Doppelbindung ausbilden kann (s. Bredtsche-Regel).[4] Dieser Mechanismus beginnt mit dem nucleophilen Angriff der verwendeten Base auf das positiv polarisierte Kohlenstoffatom des α-Halogenketons 9 (X = Cl, Br; R1 bis R4 = H, Alkyl). Daraufhin wird das Halogenid abgespalten und – je nach verwendeter Base – eine Carbonsäure 11 (R = H) oder ein Carbonsäureester 11 (R = Alkyl) erhalten:[6][8] Im Unterschied zur regulären Faworski-Umlagerung wird dabei kein Cyclopropanon-Intermediat beobachtet.

Während diese Umlagerung beim Chlorcyclopentanon nicht bekannt ist, liefert 2-Halogencyclobutanon 12 unter Ringverengung die Cyclopropancarbonsäure 14, neben 2-Hydroxycyclobutanon und stellt ein Beispiel für den beschriebenen Mechanismus dar.[9][10]

Die französischen Chemiker lieferten den Beweis, dass in diesem Fall Hydroxid am Carbonylkohlenstoffatom angreift und die benachbarte C-C-Bindung gespalten wird. Dieser Reaktionsmechanismus ähnelt der Benzilsäure-Umlagerung und wird daher auch als „Semibenzilsäure-Umlagerung“ bezeichnet.[11]
Verwendung
In der organischen Synthese werden Faworski-Umlagerungen immer dann verwendet, wenn alternative Synthesen von Carbonsäure(ester)n umständlicher sind als die von α-Halogenketonen.
Eine breite Anwendung findet die Faworski-Umlagerung bei cyclischen Verbindungen, da sich in der Regel ein n-gliedriger Ring in den nächstkleineren (n − 1)-gliedrigen Ring umwandeln lässt (sog. Ringverengung).
Besonderes Aufsehen erregte eine Synthese des gespannten Kohlenwasserstoffs Cuban durch Eaton, bei der eine Quasi-Faworski-Umlagerung ein Schlüsselschritt war.[4][12][13]
Literatur
- Christian M. Rojas: Molecular Rearrangements in Organic Synthesis. John Wiley & Sons, Inc., Hoboken, N ew Jersey, 2015, ISBN 978-3-540-30030-4, doi:10.1002/9781118939901.ch7.
- Robert Jacquier: Rearrangement des cétones α-halogénées en acides sous l’influence des reactifs alcalins (Reaction de Faworsky). In: Bull. Soc. Chim. France. 1950, S. 35–45.
- Andrew S. Kende: The Favorskiĭ Rearrangement of Haloketones. In: Organic Reactions. Nr. 11, 1960, S. 261–316, doi:10.1002/0471264180.or011.04.
- Jean M. Conia, Jacques R. Salaun: Cyclobutane ring contractions not involving carbonium ions. In: Accounts of Chemical Research. Band 5, Nr. 1, 1. Januar 1972, S. 33–40, doi:10.1021/ar50049a005.
- J. Bülle, A. Hüttermann: Das Basiswissen der Organischen Chemie. Wiley-VCH, 2000.
Einzelnachweise
- A. E. Faworskii: J. Russ. Phys. Chem. Band 26, 1894, S. 559. Deutsche Fassung: A. Faworski: Journal für praktische Chemie. Band 51, 1895, S. 533.
- Jie Jack Li: Name Reactions - A Collection of Detailed Reaction Mechanisms. Hrsg.: Springer Berlin Heidelberg. 2006, ISBN 978-3-540-30030-4, S. 220–221, doi:10.1007/3-540-30031-7_99 (springer.com [abgerufen am 27. November 2016]).
- A. Faworski, W. Boshowski: Isomeric Transformations of Cyclic α-Monochloroketones. In: J. Russ. Phys. Chem. 46, 1914, S. 1097–1102. Deutsche Fassung: Über isomere Umwandlungen der cyclischen α-Monochlorketone. In: Chemisches Zentralblatt. 1915, I, S. 984.
- Michael Harmata: Molecular Rearrangements in Organic Synthesis. John Wiley & Sons, Inc, 2015, ISBN 978-1-118-93990-1, S. 183–226, doi:10.1002/9781118939901.ch7.
- Robert Berner Loftfield: The Alkaline Rearrangement of α-Haloketones. II. The Mechanism of the Faworskii Reaction. In: Journal of the American Chemical Society. Band 73, Nr. 10, 1. Oktober 1951, S. 4707–4714, doi:10.1021/ja01154a066.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. 3 Bände. Band 1, Wiley, 2009, ISBN 978-0-471-70450-8, S. 1025.
- Edward E. Smissman, Gilbert Hite: The Quasi-Favorskii Rearrangement. I. The Preparation of Demerol and β-Pethidine. In: Journal of the American Chemical Society. Band 81, Nr. 5, 1. März 1959, S. 1201–1203, doi:10.1021/ja01514a047.
- T. Laue, A. Plagens: Namens- und Schlagwort-Reaktionen der Organischen Chemie. 5. Auflage, Teubner Studienbücher Chemie, 2006, S. 122.
- J. M. Conia, J. Salaün: Mecanisme de la transposition de Favorski de la bromo-2 cyclobutanone. In: Tetrahedron Letters. Band 4, Nr. 18, 1963, S. 1175–1177, doi:10.1016/S0040-4039(01)90798-1.
- Jean M. Conia, Jacques R. Salaun: Cyclobutane ring contractions not involving carbonium ions. In: Accounts of Chemical Research. Band 5, Nr. 1, 1. Januar 1972, S. 33–40, doi:10.1021/ar50049a005.
- Bianca Tchoubar, Otto Sackur: Déshalogénation alcaline de la chloro-I cyclohexylméthylcétone et de la chloro-1 cyclohexylphénytone. Transposition en acides cyclohexylformiques α substitués. In: Comptes rendus hebdomadaires des séances de l’Académie des sciences. Band 208, 1939, S. 1020–1022 (Digitalisat auf Gallica).
- Philip E. Eaton, Thomas W. Cole: The Cubane System. In: Journal of the American Chemical Society. Band 86, Nr. 5, 1. März 1964, S. 962–964, doi:10.1021/ja01059a072.
- Philip E. Eaton, Thomas W. Cole: Cubane. In: Journal of the American Chemical Society. Band 86, Nr. 15, 1. August 1964, S. 3157–3158, doi:10.1021/ja01069a041.