Restriktionsenzym
Restriktionsenzyme, genauer auch Restriktionsendonukleasen (REN), sind Enzyme, die DNA an bestimmten Positionen erkennen und schneiden können. Restriktionsendonukleasen treten unter anderem in Bakterien und Archaeen auf[1] und dienen dort der Abwehr von Bakteriophagen. Die Restriktionsenzyme erkennen fremde DNA am fehlenden Methylierungsmuster oder an einer sonst nicht vorkommenden DNA-Sequenz und hydrolysieren dann die Fremd-DNA. Sie treten daher im Bakterium immer zusammen mit typischen DNA-Methyltransferasen auf, die der bakterieneigenen DNA kennzeichnende Muster aufprägen.
| Restriktionsenzym | ||
|---|---|---|
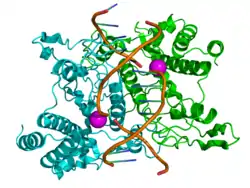
| ||
| Die Restriktionsendonuklease EcoRI (Homodimer) an DNA gebunden | ||
| Bezeichner | ||
| Gen-Name(n) | T2; R. | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.21.4, Endonuklease | |
| Reaktionsart | Hydrolyse | |
| Substrat | DNA | |
| Produkte | zwei DNA-Teilstücke | |
| Vorkommen | ||
| Übergeordnetes Taxon | Bakterien | |
Eigenschaften
Damit ein Bakterium über Restriktionsenzyme als Abwehrsystem verfügen kann, sind mindestens drei funktionell unterscheidbare Proteinbereiche notwendig: Restriktions-, Methylierungs- und Sequenzerkennungsdomäne. Diese drei Domänen können sich entweder auf nur einem Protein befinden oder auf mehrere verteilt sein.[2]
Jede Restriktionsendonuklease erkennt eine bestimmte DNA-Basensequenz. Die Spezifität eines Restriktionsenzyms bei einem Restriktionsverdau ist unter anderem vom verwendeten Puffer und den Cofaktoren abhängig.
Restriktionsenzyme werden in der Biochemie zum Schneiden von DNA an definierten Stellen eingesetzt, z. B. bei einer Restriktionsanalyse (ein Restriktionsverdau mit anschließender Agarose-Gelelektrophorese) oder einer Klonierung. Daher werden diese Enzyme auch als molekulare Scheren bezeichnet. Um die Schnittenden wieder kovalent zusammenzufügen, wird (bei sticky ends erst nach einer Hybridisierung) eine Ligase benutzt. Bei falschen Umgebungsbedingungen kann auch unspezifisch restringiert werden, was als Star-Aktivität bezeichnet wird. Die Spezifität von Restriktionsendonukleasen kann durch ein Proteindesign gezielt an eine gewünschte DNA-Sequenz angepasst werden, z. B. bei Zinkfingernukleasen.
Die Positionen der Schnittstellen einzelner Restriktionsenzyme lassen sich in Restriktionskarten einer DNA darstellen. Solche Karten gibt es beispielsweise für Genome und Plasmide. Über die Länge der DNA-Fragmente, die beim Schneiden der DNA durch Restriktionsenzyme entstehen, können DNA-Abschnitte im Vergleich mit einer Restriktionskarte identifiziert werden.
Klassifizierung
Nach ihren Eigenschaften unterscheidet man vier Haupttypen, die sich noch weiter in mehrere Subtypen aufspalten:[3]
- Typ I schneidet die DNA an einer zufälligen Stelle weit von der Erkennungssequenz entfernt. Benötigt ATP und transferiert eine Methylgruppe von S-Adenosyl-Methionin.
- Typ II schneidet die DNA innerhalb oder in unmittelbarer Nähe der Erkennungssequenz. Benötigt kein ATP und hat keine Methyltransferase-Aktivität.
- Typ III schneidet die DNA etwa 20 bis 25 Basenpaare von der Erkennungssequenz entfernt. Benötigt ATP und transferiert eine Methylgruppe von S-Adenosyl-Methionin.
- Typ IV schneidet nur methylierte/ hydroxymethylierte/ glucosyl-hydroxymethylierte DNA – im Gegensatz zu den Typen I-III, die durch Methylierungsmuster gehemmt werden.[4][5]
- Typ V (z. B. der cas9-gRNA-Komplex von CRISPRs) nutzt Guide-RNAs (gRNAs), um spezifische nicht-palindromische Sequenzen auf eindringenden Organismen anzugreifen. Er kann DNA variabler Länge schneiden, wenn eine geeignete Guide-RNA bereitgestellt wird. Wegen ihrer Flexibilität und einfachen Anwendung sind Typ-V-Restriktionsenzyme vielversprechende Kandidaten für zukünftige gentechnische Anwendungen.[6][7] Siehe auch sgRNA.
Der Typ II hat als bekannte Subtypen den Typ IIS und Typ IIG, die außerhalb der Erkennungssequenz schneiden.[8]
Im allgemeinen Sprachgebrauch wird der Begriff Restriktionsenzym meist mit den Restriktionsendonukleasen vom Typ II gleichgesetzt, da die Enzyme der Typen I und III in der Molekularbiologie nur eine geringe Bedeutung besitzen. Die Namen der Restriktionsenzyme geben ihre Herkunft an. Der erste Buchstabe steht für die Gattung, der zweite und dritte für die Art, erweitert wird es durch Namenszusätze und die chronologische Abfolge der Entdeckung. Das Enzym EcoRI ist beispielsweise das erste Enzym, das im Stamm Escherichia coli R(rough) gefunden wurde, und SmaI das erste Enzym aus Serratia marcescens. Restriktionsenzyme unterschiedlicher Herkunft mit identischer Erkennungssequenz und gleichem Schnittmuster werden Isoschizomere genannt. Schneiden sie innerhalb derselben Sequenz, hinterlassen aber unterschiedliche Schnittenden, bezeichnet man sie als Neoschizomere.
Die Erkennungssequenzen der Restriktionsendonukleasen vom Typ II bestehen meist aus palindromischen Sequenzen von vier, sechs oder acht Basenpaaren. Der Schnitt kann gerade sein (engl. blunt ends, deut. stumpfe Enden oder glatte Enden, z. B. SmaI). Solche blunt ends ergeben im Zuge einer Klonierung eine geringere Ausbeute bei der Ligation. Die Erkennungssequenz von SmaI lautet: 5'-CCCGGG-3'. Der Schnitt erfolgt zwischen dem C und dem G:
![]()
Der Schnitt kann auch versetzt sein (englisch sticky ends, deutsch klebrige Enden, z. B. EcoRI). Die Erkennungssequenz von EcoRI lautet: 5'-GAATTC-3'. Der Schnitt erfolgt zwischen dem G und dem A:
![]()
Klebrige Enden sind leichter ligierbar, da sie miteinander hybridisieren können und sich daher häufiger zusammenfinden.
Beispiele
| Enzym | Quelle | Erkennungssequenz | Schnitt | Enden |
|---|---|---|---|---|
| EcoRI | Escherichia coli |
5'-GAATTC-3' 3'-CTTAAG-5' |
5'-G AATTC-3' 3'-CTTAA G-5' |
5'–Überhang mit vier Basen (klebrige Enden) |
| EcoRV | Escherichia coli |
5'-GATATC-3' 3'-CTATAG-5' |
5'-GAT ATC-3' 3'-CTA TAG-5' |
kein Überhang (glatte Enden) |
| BamHI | Bacillus amyloliquefaciens |
5'GGATCC 3'CCTAGG |
5'---G GATCC---3' 3'---CCTAG G---5' |
5'–Überhang mit vier Basen (klebrige Enden) |
| HindIII | Haemophilus influenzae |
5'AAGCTT 3'TTCGAA |
5'---A AGCTT---3' 3'---TTCGA A---5' |
5'–Überhang mit vier Basen (klebrige Enden) |
| HaeIII | Haemophilus aegyptius |
5'GGCC 3'CCGG |
5'---GG CC---3' 3'---CC GG---5' |
kein Überhang (glatte Enden) |
| NdeI | Neisseria denitrificans |
5'-CATATG-3' 3'-GTATAC-5' |
5'-CA TATG-3' 3'-GTAT AC-5' |
5'–Überhang mit zwei Basen (klebrige Enden) |
| SacI | Streptomyces achromogenes |
5'-GAGCTC-3' 3'-CTCGAG-5' |
5'-GAGCT C-3' 3'-C TCGAG-5' |
3'–Überhang mit vier Basen (klebrige Enden) |
| SmaI | Serratia marcescens |
5'-CCCGGG-3' 3'-GGGCCC-5' |
5'-CCC GGG-3' 3'-GGG CCC-5' |
kein Überhang (glatte Enden) |
| PvuI | Proteus vulgaris |
5'-CGATCG-3' 3'-GCTAGC-5' |
5'-CGAT CG-3' 3'-GC TAGC-5' |
3'–Überhang mit zwei Basen (klebrige Enden) |
| SacI | Streptomyces achromogenes |
5'GAGCTC 3'CTCGAG |
5'---GAGCT C---3' 3'---C TCGAG---5' |
|
| SalI | Streptomyces albus |
5'GTCGAC 3'CAGCTG |
5'---G TCGAC---3' 3'---CAGCT G---5' |
(stumpfe Enden) |
| ScaI | Streptomyces caespitosus |
5'AGTACT 3'TCATGA |
5'---AGT ACT---3' 3'---TCA TGA---5' |
|
| SphI | Streptomyces phaeochromogenes |
5'-GCATGC-3' 3'-CGTACG-5' |
5'-GCATG C-3' 3'-C GTACG-5' |
3'–Überhang mit vier Basen (klebrige Enden) |
| XbaI | Xanthomonas badrii |
5'-TCTAGA-3' 3'-AGATCT-5' |
5'-T CTAGA-3' 3'-AGATC T-5' |
5'–Überhang mit vier Basen (klebrige Enden) |
Geschichte
Mit der Entdeckung der Restriktionsenzyme 1967/68[11] durch Isolierung aus Bakterien begann die Entwicklung der Molekularbiologie. Sie ermöglichen die gezielte Herstellung von DNA-Fragmenten (Restriktionsfragmente), die dann isoliert und seit 1972 mit Hilfe von Ligasen zu neuen Konstruktionen zusammengesetzt werden können. Enzyme, die klebrige Enden erzeugen, sind dabei besonders hilfreich, da sich die überlappenden Enden leicht miteinander verbinden lassen. Der erste Artikel einer Forschergruppe der Stanford University School of Medicine erschien 1973 in den Proceedings of the National Academy of Sciences. Für ihre grundlegenden Arbeiten zur „Entdeckung der Restriktionsenzyme und ihre Anwendung in der Molekulargenetik“ bekamen Werner Arber, Daniel Nathans und Hamilton Othanel Smith 1978 den Nobelpreis für Physiologie oder Medizin.[12]
Der Name Restriktionsenzym stammt von dem bakteriellen Restriktions-Modifikationssystem, das der Abwehr fremder (viraler) DNA dient. Viele Bakterien besitzen stammspezifische Restriktionsendonukleasen. In der eigenen DNA sind die entsprechenden Erkennungssequenzen modifiziert (methyliert) und werden daher nicht geschnitten. Wenn Viren, die sich in den Bakterien vermehren (Bakteriophagen), ihre DNA in die Zellen injizieren, ist diese nicht methyliert und wird abgebaut. Nur Viren, die aus Bakterien desselben Stammes kommen, besitzen das richtige Methylierungsmuster und können sich weiter vermehren. Die Vermehrung der Viren ist damit auf diesen Stamm eingeschränkt oder restringiert. (Restriktion = Beschränkung).
Einzelnachweise
- Applied Microbial Systematics, F. G. Priest, Michael Goodfellow, ISBN 0-7923-6518-6, eingeschränkte Vorschau in der Google-Buchsuche
- Cornel Mülhardt: Der Experimentator: Molekularbiologie/Genomics, Springer 2008, ISBN 3-8274-2036-9, Seite 48 (Vorschau bei Google Books).
- Roberts, R.J. et al. (2003): A nomenclature for restriction enzymes, DNA methyltransferases, homing endonucleases and their genes. (PDF; 93 kB) In: Nucleic Acids Res. Bd. 31, S. 1805–1812. PMID 12654995
- Cornel Mülhardt: Allgemeine Mikrobiologie, Georg Fuchs, Hans G. Schlegel, Georg Thieme Verlag, 2006,ISBN 3-13-444608-1, Seite 468 eingeschränkte Vorschau in der Google-Buchsuche.
- Cornel Mülhardt: Der Experimentator: Molekularbiologie/Genomics, Springer 2008, ISBN 3-8274-2036-9, Seite 48 (Vorschau bei Google Books).
- R. Barrangou, C. Fremaux, H. Deveau, M. Richards, P. Boyaval, S. Moineau, D. A. Romero, P. Horvath: CRISPR provides acquired resistance against viruses in prokaryotes. In: Science. 315, Nr. 5819, März 2007, S. 1709–1712. bibcode:2007Sci...315.1709B. doi:10.1126/science.1138140. PMID 17379808.
- P. Horvath, R. Barrangou: CRISPR/Cas, the immune system of bacteria and archaea. In: Science. 327, Nr. 5962, Januar 2010, S. 167–170. bibcode:2010Sci...327..167H. doi:10.1126/science.1179555. PMID 20056882.
- Restriktionsenzyme - Werkzeuge der Molekularbiologie. In: New England Biolabs GmbH. Abgerufen am 27. Februar 2020.
- R. J. Roberts: Restriction and modification enzymes and their recognition sequences. In: Nucleic Acids Research. 8, Nr. 1, Januar 1980, S. r63–r80. doi:10.1093/nar/8.1.197-d. PMID 6243774. PMC 327257 (freier Volltext).
- Harvey F. Lodish: Molecular Cell Biology, 5. Auflage, W. H. Freeman and Company, New York 2004, ISBN 0-7167-4366-3.
- Hans-Peter Kröner: Humangenetik. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 635–641, hier: S. 640 (Humangenetik in der molekularbiologischen Epoche).
- Informationen der Nobelstiftung zur Preisverleihung 1978 an Werner Arber, Daniel Nathans und Hamilton O. Smith (englisch)
Weblinks
- REBASE – umfassendste Datenbank aller bekannten Restriktionsenzyme, einschließlich Verfügbarkeit durch alle kommerziellen Hersteller (englisch)
- NEBCutter – Web-basiertes Programm zum Schneiden von DNA mit sämtlichen verfügbaren Restriktionsenzymen; beachtet Methylierungssensitivitäten; Simulation von Gelen (englisch)
- WatCut – Web-basiertes Programm zum Schneiden von DNA mit Restriktionsenzymen (englisch)