Prasinovirus
Prasinovirus ist eine Gattung von großen doppelsträngigen DNA-Viren aus der Familie der Phycodnaviridae, die Phytoplankton der Prasinophyceae infizieren. Derzeit (Stand Juli 2019) gibt es in dieser Gattung nur zwei Arten:[2] die Typusart Micromonas pusilla-Virus SP1 (MpV-SP1),[3] sowie Ostreococcus tauri-Virus OtV5 (OtV5). Mitglieder der Gattung Prasinovirus infizieren kleine einzellige Grünalgen der Ordnung Mamiellales [en], die häufig in den Gewässern an der Meeresküste vorkommen.[4] Gemeinsame Wirte von Prasinoviren umfassen Mitglieder der Flagellaten-Gattungen Ostreococcus und Micromonas. Drei Arten von Ostreococcus wurden als Kandidaten identifiziert, die sich aufgrund ihres Lichtbedarfs unterscheiden.[5]
| Prasinovirus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Negativ-Bild von MpV-SP1 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Prasinovirus | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Beschreibung
Die Typusart der Gattung Prasinovirus ist das Micromonas pusilla-Virus SP1 (MpV-SP1),[2] das aus einer aus San Diego entnommenen Wasserprobe isoliert wurde.[6]
Das Prasinovirus MpV-SP1 infiziert die Flagellate Micromonas pusilla (UTEX 991, Plymouth 27), welches ein dominierender photosynthetischer mariner Picoeukaryot ist, also zum eukaryotischen Pikoplankton gehört.[6][7]
Eines der am häufigsten untersuchten Prasinoviren, OtV5, dessen Genom vollständig sequenziert ist, infiziert Ostreococcus tauri, die bis dato (2008) kleinsten frei lebenden Eukaryoten.[8]
Aufbau
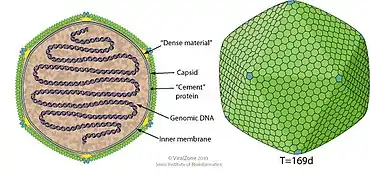
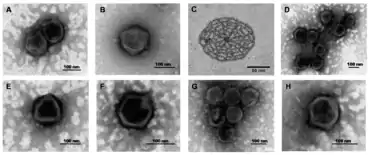
Virionen der Gattung Prasinovirus haben ikosaedrische und runde Geometrie mit T=169-Symmetrie. Der Durchmesser liegt bei 104–118 nm.[3] Bei „Ostreococcus tauri-Virus OtV1“ (OtV-1) beträgt der Durchmesser der Virionen (Virusteilchen) 100–120 nm,[10] bei Ostreococcus tauri-Virus OtV5 (OtV-5) 122±9 nm,[11] und bei „Micromonas polaris virus“ (MpoV) ca. 120 nm.[12]
Vermehrungszyklus
Die virale Replikation ist nukleo-zytoplasmatisch. Die Replikation folgt dem DNA-Strang-Verdrängungsmodell (englisch DNA strand displacement model). Die Methode der Transkription ist DNA-gestützt. Das Virus verlässt die Wirtszelle durch Lyse über lytische Phospholipide. Als natürlicher Wirt dienen Algen, die Übertragung erfolgt durch passive Diffusion.
Bei der nukleo-zytoplasmatischen Replikation der Prasinoviren heften sich die Virusteilchen (Virionen) an der Oberfläche der Wirtszelle an und injizieren anschließend ihre DNA in das Zytoplasma der Wirtszelle injizieren.[8] Offenbar lösen sich die Reste der Virionen nach Injektion ihrer DNA von der Wirtsmembran. Man fand nämlich heraus, dass „leere“ OtV5-Virionen bzw. Virusüberreste, bei denen nur das Kapsid an die Wirtsmembran gebunden ist, in keinem Stadium der Infektion zu sehen sind. Die Autoren stellten auch fest, dass ein hoher Anteil der Viren nach der Einimpfung (englisch inoculation) der DNA nicht an Zellen anhaftete, was nahelegt, dass die Anhaftung von Viren ein begrenzender Schritt bei der Infektion sein könnte. Die virale DNA wird dann durch die Maschinerie der Wirtszelle im Zellkern repliziert. Die Viruspartikel sammeln sich im Zytoplasma an und nehmen normalerweise einen Raum nahe der Innenseite des Zellkerns ein. Aufgrund der extrem geringen Größe der Algenzellen wurde eine durchschnittliche Burstgröße von nur 25 Viruspartikeln pro Zelle festgestellt.[8]
Inzwischen wurde in O. tauri-Zellen auch eine Virusproduktion ohne Zelllyse beobachtet. Thomas et al. fanden 2011 heraus, dass in resistenten Wirtszellen das Virusgenom repliziert und Viren über einen Knospungsmechanismus (englisch budding mechanism) freigesetzt wurden.[13] Diese geringe Freisetzungsrate von Viren durch Knospungen ermöglicht eine längere Überlebensdauer des Wirts und der Virusnachkommen, was zu einer stabilen Koexistenz führt.[14]
Genom
- Bei Ostreococcus tauri-Virus OtV1 (OtV-1) liegt die Länge des Genoms bei 191.761 bp, es kodiert vorhergesagt für 230 Proteine, und der GC-Gehalt liegt bei 45 %.[16]
- Bei Ostreococcus tauri-Virus OtV5 (OtV-5) beträgt die Länge des Genoms 187 bp und der GC-Gehalt 45 %.[11]
- Bei Bathycoccus sp. RCC1105 virus BpV1 beträgt die Genomlänge 198.519 bp, es werden vorhergesagt 203 Proteine kodiert und der GC-Gehalt liegt bei 37 %.[16]
Es gibt eine große Gruppe genetisch unterschiedlicher, aber verwandter Viren, die starke Hinweise auf lateralen Gentransfer zeigen.[17][15]
Systematik
Innere Systematik
Systematik nach ICTV (Stand Juni 2021, Master Species List #36 2020v1):[1][2][9]
- Familie: Phycodnaviridae
- Genus: Prasinovirus
Bis dato nicht vom ICTV bestätigt sind:[9][20]
- Spezies: „Ostreococcus tauri-Virus OtV1“ (OtV-1)[10]
- Spezies: „Ostreococcus tauri-Virus OtV2“ (OtV-2)[21]
- Species: „Bathycoccus prasinos virus“ („Bathycoccus sp. RCC1105 virus BpV“, BpV)[22][23]
- Spezies: „Ostreococcus lucimarinus virus OlV1“ (OlV-1)[18]
- Spezies: „Ostreococcus lucimarinus virus OlV2“ (OlV-2)[18]
- Spezies: „Ostreococcus lucimarinus virus OlV7“ (OlV-7)[18]
- Spezies: „Ostreococcus mediterraneus virus OmV1“ (OmV-1)[18]
- Spezies: „Micromonas pusilla-Virus MpV1“ (MpV-1)[18][25]
- Spezies: „Micromonas pusilla-Virus PL1“ (MpV-PL1)[18]
- Spezies: „Micromonas pusilla-Virus 12T“ (MpV-12T, T steht für Texel, Niederlande, infiziert M. pusilla Stamm LAC38)[18][27][28]
- Spezies: „Micromonas pusilla-Virus 03T“ (MpV-03T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 06T“ (MpV-06T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 08T“ (MpV-08T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 09T“ (MpV-09T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 10T“ (MpV-10T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 11T“ (MpV-11T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 14T“ (MpV-14T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 39T“ (MpV-39T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 42T“ (MpV-42T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas pusilla-Virus 43T“ (MpV-43T, infiziert M. pusilla Stamm LAC38, nahe MpV-12T)[27]
- Spezies: „Micromonas polaris virus“ (MpoV, nach NCBI nicht näher klassifiziertes Mitglied der Phycodnaviridae,[29] nach Maat et al. (2017) gehört es ebenfalls zur Gattung Prasinovirus[12])
- Spezies: „Micromonas virus Mi1109V14“ (Mi1109V14)
- Spezies: „Micromonas virus Mi497V14“ (Mi497V14)
- Spezies: „Micromonas virus Mi829V1“ (Mi829V1)
- Spezies: „Micromonas virus Mic497V2“ (Mic497V2)
- Spezies: „Micromonas virus MicAV8“ (MicAV8)
- Spezies: „Micromonas virus MicAV11“ (MicAV11)
- Spezies: „Micromonas virus MicAV16“ (MicAV16)
- Spezies: „Micromonas virus MicAV17“ (MicAV17)
- Spezies: „Micromonas virus MicAV27“ (MicAV27)
- Spezies: „Micromonas virus MicAV29“ (MicAV29)
- Spezies: „Micromonas virus MicAV30“ (MicAV30)
- Spezies: „Micromonas virus MicBV10“ (MicBV10)
- Spezies: „Micromonas virus MicBV26“ (MicBV26)
- Spezies: „Micromonas virus MicBV30“ (MicBV30)
- Spezies: „Micromonas virus MicBV39“ (MicBV39)
- Spezies: „Micromonas virus MicCV9“ (MicCV9)
- Spezies: „Micromonas virus MicCV32“ (MicCV32)
- Spezies: „Micromonas sp. RCC1109 virus MpV1“ (MpV1)
- Spezies: „Ostreococcus tauri-Virus RT-2011“ (OtV RT-2011)[18]
- Spezies: „Ostreococcus tauri-Virus OtV06“ (OtV06)[19]
- Spezies: „Ostreococcus tauri-Virus OtV08“ (OtV08)[19]
- Spezies: „Ostreococcus tauri-Virus OtV09“ (OtV09)[19]
- Spezies: „Dishui Lake Phycodnavirus 4“ (DSLPV4)[30]
Phylogenetischer Baum nach Hao et al. (2018):[18]
| Prasinovirus |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Äußere Systematik
Die folgende Systematik folgt Schulz et al. (2018) mit Korrekturen und Ergänzungen nach Hao et al. (2018):[31][18]
| Phycodnaviridae |
| ||||||||||||||||||||||||||||||||||||||||||||||||
YSLPV = „Yellowstone Lake Phycodnavirus“
DSLPV = „Dishui Lake Phycodnavirus“
Greiner et al. (2018) sehen YLPV2 (alias YSLPV2, Yellowstone Phycodnavirus 2) jedoch nicht in der Klade der Viren vom Chlorovirus-Typ.[25]
Weblinks
- Viralzone: Prasinovirus
- ICTV
- Sheree Yau, Marc Krasovec, L. Felipe Benites, Stephane Rombauts, Mathieu Groussin et al.: Virus-host coexistence in phytoplankton through the genomic lens, in: Science Advances Band 6, Nr. 14, 1. April 2020, eaay2587, doi:1126/sciadv.aay2587
Einzelnachweise
- ICTV: ICTV Master Species List 2020.v1, New MSL including all taxa updates since the 2019 release, March 2021 (MSL #36)
- ICTV: Virus Taxonomy. Abgerufen am 7. Juli 2019., auf: International Committee on Taxonomy of Viruses Master Species List (MSL) #34 2018b.
- Viral Zone. ExPASy. Abgerufen am 7. Juli 2019.
- Camille Clerissi, Yves Desdevises, Nigel Grimsley: Prasinoviruses of the Marine Green Alga Ostreococcus tauri Are Mainly Species Specific. In: Journal of Virology. 86, Nr. 8, 2012, S. 4611–4619. doi:10.1128/JVI.07221-11. PMID 22318150. PMC 3318615 (freier Volltext).
- Home Ostreococcus lucimarinus. In: genome.jgi.doe.gov. Abgerufen am 28. Februar 2017.
- Matthew T. Cottrell, Curtis A. Suttle: Wide-spread occurrence and clonal variation in viruses which cause lysis of a cosmopolitan, eukaryotic marine phytoplankter Micromonas pusilla. In: Marine Ecology Progress Series. 78, 1991, S. 1–9. bibcode:1991MEPS...78....1C. doi:10.3354/meps078001.
- Matthew T. Cottrell, Curtis A. Suttle: Dynamics of lytic virus infecting the photosynthetic marine picoflagellate Micromonas pusilla. In: Limnology and Oceanography. 40, Nr. 4, 1995, S. 730–739. doi:10.4319/lo.1995.40.4.0730.
- Nigel Grimsley, Hervé Moreau, Laure Bellec, Yves Desdevises, Gwenaël Piganeau, Richard Cooke, Sophie Eychenié, Marie-Line Escande, Conchita Ferraz, Evelyne Derelle: Life-Cycle and Genome of OtV5, a Large DNA Virus of the Pelagic Marine Unicellular Green Alga Ostreococcus tauri. In: PLOS ONE. Band 3, Nr. 5, 28. Mai 2008, S. e2250, doi:10.1371/journal.pone.0002250, PMID 18509524, PMC 2386258 (freier Volltext), bibcode:2008PLoSO...3.2250D.
- Karen D. Weynberg, Michael J. Allen, William H. Wilson: Marine Prasinoviruses and Their Tiny Plankton Hosts: A Review, in: MDPI Viruses, Band 9, Nr. 3, 15. März 2017, Special Issue Marine Viruses 2016, 43, doi:10.3390/v9030043. Insbes. Tbl 1.
- Weynberg KD, Allen MJ, Ashelford K, Scanlan DJ, Wilson WH: From small hosts come big viruses: the complete genome of a second Ostreococcus tauri virus, OtV-1, in: Environmental Microbiology, 23. Juli 2009, 11(11). S. 2821–2839, PMID 19650882, doi:10.1111/j.1462-2920.2009.01991.x
- Jean-Michel Claverie, Chantal Abergel: Mimiviridae: An Expanding Family of Highly Diverse Large dsDNA Viruses Infecting a Wide Phylogenetic Range of Aquatic Eukaryotes. In: Viruses. 2018 Sep; 10(9), 18. September 2018, S. 506, doi:10.3390/v10090506, PMC 6163669 (freier Volltext), PMID 30231528, Tab. 2
- Douwe S. Maat, Tristan Biggs, Claire Evans, Judith D. L. Van Bleijswijk, Nicole N. Van der Wel, Bas E. Dutilh, Corina P. D. Brussaard: Characterization and Temperature Dependence of Arctic Micromonas polaris Viruses, Special Issue: Marine Viruses 2016. In: MDPI Viruses. 9, Nr. 6, 2. Juni 2017, S. 134. doi:10.3390/v9060134. PMID 28574420. PMC 5490811 (freier Volltext).
- Thomas Rozenn, Nigel Grimsley, Marie-Line Escande, Lucie Subirana, Evelyne Derelle, Hervé Moreau: Acquisition and maintenance of resistance to viruses in eukaryotic phytoplankton populations. In: Environmental Microbiology. 13, Nr. 6, 2011, S. 1412–1420. doi:10.1111/j.1462-2920.2011.02441.x. PMID 21392198.
- Télesphore Sime-Ngando: Environmental bacteriophages: Viruses of microbes in aquatic ecosystems. In: Frontiers in Microbiology. 5, 2014, S. 355. doi:10.3389/fmicb.2014.00355. PMID 25104950. PMC 4109441 (freier Volltext).
- Curtis A. Suttle, Amy M. Chan, Danielle M. Winget, Jan F. Finke: Variation in the Genetic Repertoire of Viruses Infecting Micromonas pusilla Reflects Horizontal Gene Transfer and Links to Their Environmental Distribution. In: Viruses. Band 9, Nr. 5, 2017, S. 116, doi:10.3390/v9050116, PMID 28534829.
- David M. Needham, Alexandra Z. Worden et al.: A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators, in: PNAS, 23. September 2019, doi:10.1073/pnas.1907517116, ISSN 0027-8424, hier: Supplement 1 (xlsx)
- Laure Bellec, Nigel Grimsley, Evelyn Derelle, Herve Moreau, Yves Desdevises: Abundance, spatial distribution and genetic diversity of Ostreococcus tauri viruses in two different environments. In: Environmental Microbiology Reports. 2, Nr. 2, 2010, S. 313–321. doi:10.1111/j.1758-2229.2010.00138.x. PMID 23766083.
- Hao Chen, Weijia Zhang, Xiefei Li, Yingjie Pan, Shuling Yan, Yongjie Wang: The genome of a prasinoviruses-related freshwater virus reveals unusual diversity of phycodnaviruses, in: BMC Genomics, Dezember 2018, doi:10.1186/s12864-018-4432-4
- Camille Clerissi, Yves Desdevises, Nigel Grimsley: Prasinoviruses of the Marine Green Alga Ostreococcus tauri Are Mainly Species Specific, in: Journal of Virology 86(8), S. 4611–4619, Februar 2012, doi:10.1128/JVI.07221-11
- NCBI: unclassified Prasinovirus (list)
- Karen D. Weynberg, Michael J. Allen, Ilana C. Gilg, David J. Scanlan, William H. Wilson: Genome Sequence of Ostreococcus tauri Virus OtV-2 Throws Light on the Role of Picoeukaryote Niche Separation in the Ocean, in: J Virolv.85(9); Mai 2011, PMC 3126241 (freier Volltext), PMID 21289127, doi:10.1128/JVI.02131-10
- NCBI: Bathycoccus sp. RCC1105 virus BpV (Species)
- William H. Wilson, Ilana C. Gilg, Mohammad Moniruzzaman, Erin K. Field, Sergey Koren, Gary R. LeCleir, Joaquín Martínez Martínez, Nicole J. Poulton, Brandon K. Swan, Ramunas Stepanauskas, Steven W. Wilhelm: Genomic exploration of individual giant ocean viruses, in: ISME Journal 11(8), August 2017, S. 1736–1745, doi:10.1038/ismej.2017.61, PMC 5520044 (freier Volltext), PMID 28498373
- NCBI: Bathycoccus sp. RCC1105 virus BpV1 (no rank)
- Timo Greiner, Anna Moroni, James L. Van Etten, Gerhard Thiel: Genes for Membrane Transport Proteins: Not So Rare in Viruses, in: MDPI Viruses Band 10, Nr. 9, Special Issue Algae Virus, 26 August 2018, 456; doi:10.3390/v10090456
- NCBI: Bathycoccus sp. RCC1105 virus BpV2 (no rank)
- Joaquín Martínez Martínez, Arjan Boere, Ilana Gilg, Jan W. M. van Lent, Harry J. Witte, Judith D. L. van Bleijswijk, Corina P. D. Brussaard: New lipid envelope-containing dsDNA virus isolates infecting Micromonas pusilla reveal a separate phylogenetic group, in: AME Band 74, Nr. 1, S. 17–78, Januar 2015, doi:10.3354/ame01723, ResearchGate, PDF; insbes. Fig. 2.
- NCBI: Micromonas pusilla virus 12T (species, unclassified Prasinovirus)
- NCBI: Micromonas polaris virus (species)
- Shengzhong Xu, Liang Zhou, Xiaosha Liang, Yifan Zhou, Hao Chen, Shuling Yan, Yongjie Wang; Julie K. Pfeiffer (Hrsg.): Novel Cell-Virus-Virophage Tripartite Infection Systems Discovered in the Freshwater Lake Dishui Lake in Shanghai, China, in: Journal of Virology, 18. Mai 2020, doi:10.1128/JVI.00149-20, PMID 32188734
- Frederik Schulz, Lauren Alteio, Danielle Goudeau, Elizabeth M. Ryan, Feiqiao B. Yu, Rex R. Malmstrom, Jeffrey Blanchard, Tanja Woyke: Hidden diversity of soil giant viruses, in: Nature Communicationsvolume 9, Article number: 4881 (2018) vom 19. November 2018, doi:10.1007/s00705-016-2853-4
- Fumito Maruyama, Shoko Ueki: Evolution and Phylogeny of Large DNA Viruses, Mimiviridae and Phycodnaviridae Including Newly Characterized Heterosigma akashiwo Virus. In: Front. Microbiol. 30. November 2016, doi:10.3389/fmicb.2016.01942, PMC 5127864 (freier Volltext), PMID 27965659.
- Eugene V. Koonin, Natalya Yutin: Multiple evolutionary origins of giant viruses, in: F1000 Research. 22. November 2018, doi:10.12688/f1000research.16248.1, version 1.