Chlor(trimethyl)silan
Chlor(trimethyl)silan ist eine farblose, wasserklare, an feuchter Luft rauchende Flüssigkeit mit erstickend-stechendem Geruch. Es gehört zur Gruppe der halogenierten Silane und ist eine wichtige Basischemikalie in der organisch-chemischen Synthese, besonders in der Schutzgruppenchemie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
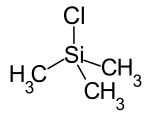 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chlor(trimethyl)silan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H9ClSi | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,64 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,854 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
heftige Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−382,8 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Chlor(trimethyl)silan wird gemeinsam mit Dichlor(dimethyl)silan und Trichlor(methyl)silan über die Müller-Rochow-Synthese hergestellt. Dabei reagiert gepulvertes Silicium mit Chlormethan bei 350 °C in Gegenwart von gepulvertem Kupfer und Kupferoxid als Katalysator zunächst zu Dichlor(dimethyl)silan, das unter den Reaktionsbedingungen zu Chlor(trimethyl)silan und Trichlor(methyl)silan disproportioniert:
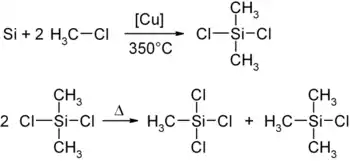
Das Produktgemisch kann aufgrund der unterschiedlichen Siedepunkte seiner Komponenten destillativ getrennt werden. Spuren von Chlorwasserstoff, der evtl. durch Hydrolyse im Chlor(trimethyl)silan vorhanden ist, können durch Destillation unter Zusatz von wenig Chinolin entfernt werden.
Eigenschaften
Physikalische Eigenschaften
Chlor(trimethyl)silan ist eine farblose, leicht bewegliche Flüssigkeit. Es besitzt mit 0,85 g/cm3 eine geringere Dichte als Wasser. Es ist recht leicht flüchtig und siedet bei 57 °C.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend:
im Temperaturbereich von 274,3 bis 326,0 K.[5] Mit den meisten nicht-protischen Lösungsmitteln (z. B. Hexan, Benzol, Toluol, Diethylether, Tetrahydrofuran, Chloroform, Dichlormethan, Ethylacetat etc.) ist es in jedem Verhältnis mischbar.
Chemische Eigenschaften
Chlor(trimethyl)silan ist eine typisch elektrophile Substanz, die am Siliciumatom sehr leicht von Nukleophilen angegriffen wird. Dies äußert sich bereits in seiner Hydrolyseempfindlichkeit. Bei Kontakt mit Wasser wird das Chlor(trimethyl)silan zunächst in heftiger Reaktion unter Wärmeentwicklung und Bildung von Chlorwasserstoff zu Trimethylsilanol hydrolysiert, das unbeständig ist und unter Wasserabspaltung zum wasserunlöslichen Bis(trimethylsilyl)ether (Hexamethyldisiloxan) kondensiert. Die Hydrolysewärme beträgt −46,8 kJ·mol−1.[6]
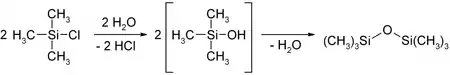
Im Labormaßstab kann Chlor(trimethyl)silan durch Destillation über Calciumhydrid aufgereinigt werden.
Als typische Lewissäure koordiniert Chlor(trimethyl)silan an Verbindungen, die freie Elektronenpaare besitzen. Mit zahlreichen protischen Verbindungen (z. B. Alkohole, Peroxide), deren Salzen und einigen speziellen Ethern reagiert es unter Bildung des entsprechenden Silylether (Me3SiOR). Bei protischen Verbindungen ist die Zugabe einer Base, welche den gebildeten Chlorwasserstoff abfängt, notwendig. Die Trimethylsilylgruppe wird aufgrund dieser Eigenschaft auch als Edelproton bezeichnet. Gegenüber nicht-protischen Stoffen ist es weitgehend inert.
Mit geeigneten Reduktionsmitteln (z. B. Lithiumaluminiumhydrid) reagiert Chlortrimethylsilan zu Trimethylsilan, (CH3)3SiH.
Verwendung
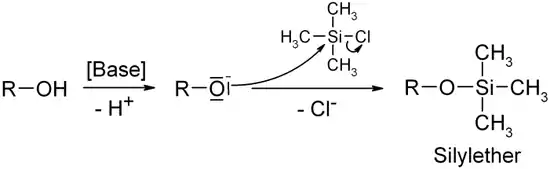
Chlor(trimethyl)silan wird in der organisch-chemische Synthese vorwiegend zur Einführung von Trimethylsilyl-Gruppen in Moleküle verwendet. Durch Deprotonierung an einer entsprechend aciden Position wird ein Anion gebildet, das nukleophil am Siliciumatom angreift und im Sinne einer SN2-Reaktion ein Chloridion freisetzt. Auf diese Weise stellt man aus Alkoholen Chlor(trimethyl)silan her. Es können aber auch nicht-ionische Nukleophile am Silicium angreifen und silyliert werden. Der dabei entstehende Chlorwasserstoff wird durch eine dem Reaktionsmedium zugesetzte Base neutralisiert.
Oft ist es nicht nötig, ein Anion durch Deprotonierung zu erzeugen. Zur Verbesserung der Reaktivität kann man auch die Elektrophilie der Trimethylsilylgruppe erhöhen. Dazu wird eine organische Stickstoffbase eingesetzt und praktischerweise so gewählt, dass sie nicht nur mit dem entstehenden Chlorwasserstoff, sondern auch bereits mit dem Chlortrimethylsilan reagiert. Dabei bildet sich zunächst ein N-silyliertes, quartäres Ammoniumsalz, das nun die Trimethylsilylgruppe auf das zu silylierende Molekül überträgt. Im abgebildeten Beispiel wird Pyridin als Base eingesetzt. Das intermediäre N-Trimethylsilylpyridiniumchlorid ist ein sehr gutes Silylierungsmittel, da die Elektrophilie des Si-Atoms durch die benachbarte positive Ladung am Stickstoff erhöht wird. Weitere geeignete Basen sind u. a. Imidazol, Triethylamin und Hünig-Base. Die beiden letztgenannten Basen sind am Stickstoffatom sterisch zu stark gehindert, um mit der ebenfalls sehr sperrigen Trimethylsilylgruppe zu reagieren. Deshalb gibt man bei Verwendung solcher Basen zur intermediären Bildung eines N-trimethylsilylierten Ammoniumsalzes zusätzlich eine katalytische Menge DMAP (4-(Dimethylamino)pyridin) hinzu.
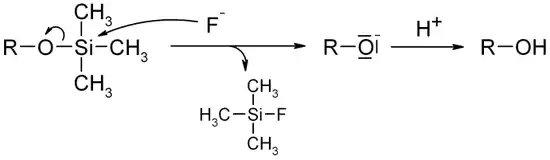
Auf Heteroatomen werden solche Trimethylsilylgruppen meist als Schutzgruppen verwendet. Die Abspaltung kann z. B. mit Fluoridionen erfolgen, da Silicium eine sehr hohe Affinität zu Fluor hat.
An Kohlenstoffatomen gebundene Trimethylsilylgruppen zeigen aber auch eine aktivierende Wirkung auf das entsprechende C-Atom. Die macht man sich u. a. in der Peterson-Olefinierung (eine Alternative zur Wittig-Reaktion bzw. zur Horner-Wadsworth-Emmons-Reaktion) zunutze.
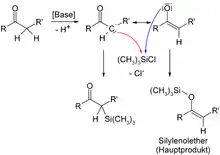
Aufgrund der hohen Stabilität von Si–O-Bindungen reagiert Chlortrimethylsilan mit ambidenten Nukleophilen, beispielsweise Enolaten, bevorzugt am Sauerstoff. Auf diese Weise werden aus α-deprotonierbaren Aldehyden oder Ketonen sogenannte Silylenolether gebildet. Die dazu isomeren, C-silylierten Produkte werden meist nur im Unterschuss gebildet.
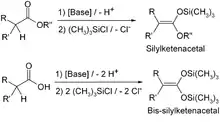
Analog dazu erhält man aus α-deprotonierbaren Estern und Carbonsäuren die Silylketenacetale bzw. die Bis-silylketenacetale. Silylenolether und Silylketenacetale spielen als latente Nukleophile in der Synthesechemie, besonders bei stereoselektiven Umsetzungen, eine bedeutende Rolle.
In der Rühlmann-Variante der Acyloin-Kondensation dient TMS-Cl als Abfangreagenz. Gegenüber elementarem Natrium verhält es sich praktisch inert.
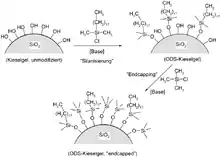
Ein weiteres wichtiges Anwendungsgebiet für Chlor(trimethyl)silan ist die Herstellung von hydrophobisierten Kieselgelen (so genannte reverse-phase-Kieselgele) für die Säulenchromatographie, besonders für die HPLC. Eines der am häufigsten verwendete hydrophoben Kieselgele ist auf der Oberfläche mit Octadecyldimethylsilyl-Gruppen (ODS-Gruppen) modifiziert („silanisiert“). Da diese sperrigen Gruppen aus Platzgründen aber nicht alle polaren OH-Gruppen auf der Kieselgeloberfläche besetzen können, lässt man das Kieselgel in einem zweiten Reaktionsschritt mit Chlortrimethylsilan reagieren, um auch die verbleibenden polaren Gruppen in unpolare Silylether umzuwandeln. Diesen Prozess bezeichnet man als Endcapping.
Auch Glasoberflächen können durch Kontakt mit Chlor(trimethyl)silan silanisiert werden. Chemisch gesehen ist es derselbe Prozess, wie das Endcapping von Kieselgelen. Die Glasoberfläche ist nach dieser Behandlung vorübergehend nicht mehr von Wasser benetzbar, so dass das Wasser fast rückstandsfrei abperlt (so, als wäre die Oberfläche fettig). Wahrscheinlich aufgrund mechanischen Abriebs hält der Effekt nur eine gewisse Zeit an, dann muss das Glas erneut behandelt werden.
Sicherheitshinweise
Chlor(trimethyl)silan hydrolysiert an feuchter Luft unter Bildung von Chlorwasserstoff, der an Haut, Augen, Schleimhäuten und Atemwegen starke Verätzungen hervorrufen kann.
Einzelnachweise
- Eintrag zu Trimethylchlorsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2020. (JavaScript erforderlich)
- Eintrag zu Methylchlorsilane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- T. Rugina, M. Gaspar, L. Sacarescu: Liquid-vapor equilibrium for a binary system of dichlorodimethyl-silane with trichloromethylsilane, chloromethylsilane and silicontetrachloride. In: Rev. Chim. (Bucharest). 38, 1987, S. 680.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- A. Capkova, V. Fried: Gleichgewicht Flussigkeit-Dampf im System Tetrachlorsilan-Trimethylchlorsilan. In: Collect Czech Chem Commun. 29, 1964, S. 336–340, doi:10.1135/cccc19640336.
- A. E. Beezer, C. T. Mortimer: Heat of formation and bond energies. Part XV. Chlorotrimethylsilane and Hexamethyldisilazan. In: J. Chem. Soc. A. 1966, S. 514–516. doi:10.1039/J19660000514


