Paraldehyd
Paraldehyd ist eine chemische Verbindung. Es ist das Trimer des Acetaldehyd. Es handelt sich um ein cyclisches Vollacetal. Entsprechend ist das Molekül instabil, schon gegenüber verdünnten Säuren. Paraldehyd ist ein Wirkstoff aus der Gruppe der Sedativa mit beruhigenden, schlaffördernden und krampflösenden Eigenschaften. Es wird heutzutage kaum mehr eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
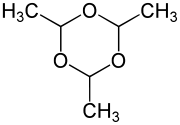 | ||||||||||||||||||||||
| Strukturformel des Trimers von Acetaldehyd ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Paraldehyd | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H12O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit süßlichem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05CC05 | |||||||||||||||||||||
| Wirkstoffklasse |
Sedativum, Hypnotikum | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 132,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
124 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,405 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Das 1829 von Wiedenbusch entdeckte Paraldehyd wurde 1913 in London von H. Noel und H. S. Soutarr zusammen mit einer Äther-Kochsalz-Lösung für die intravenöse Narkose benutzt.[6]
Gewinnung und Darstellung
Paraldehyd entsteht durch Cyclisierung von drei Molekülen Acetaldehyd in Gegenwart von Schwefelsäure. Die Produktbildung der Cyclisierungsreaktion ist temperaturabhängig. Bei Raumtemperatur ist die Bildung des Trimers bevorzugt. Bei niedrigeren Temperaturen um −10 °C entsteht eher das Tetramer Metaldehyd.[7]
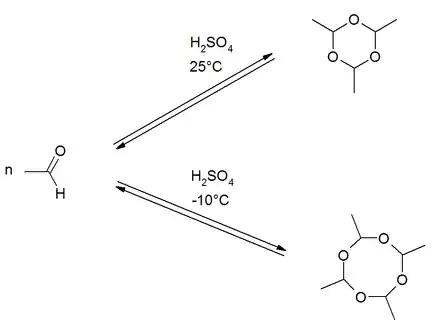
Die Trimerisungsreaktion verläuft exotherm, wobei eine Reaktionswärme von −113 kJ·mol−1 abgeschätzt werden kann.[8]
Eigenschaften
Physikalische Eigenschaften
Paraldehyd ist eine farblose Flüssigkeit mit einem durchdringenden etherartigen Geruch.[8] Sie ist mit typischen organischen Lösungsmitteln mischbar sowie in Wasser gut löslich.[8] Die Löslichkeit in Wasser sinkt dabei mit steigender Temperatur.
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−681,8 kJ·mol−1[9] −636 kJ·mol−1[9] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3394,2 kJ·mol−1[9] | als Flüssigkeit |
| Wärmekapazität | cp | 257,3 J·mol−1·K−1 (25 °C)[10] 1,947 J·g−1·K−1 (25 °C)[10][8] |
als Flüssigkeit |
| Kritische Temperatur | Tc | 563 K[11] | |
| Schmelzenthalpie | ΔfH | 13,52 kJ·mol−1[12] | |
| Verdampfungsenthalpie | ΔVH | 41,5 kJ·mol−1[13] | beim Normaldrucksiedepunkt |
| Viskosität | 1,31 mPa·s−1[8] | bei 20 °C | |
| Brechungsindex | 1,4049[8] | bei 20 °C |
Stereochemie
Für die Molekülstruktur können zwei Stereoisomere formuliert werden, die als cis- (1) und trans-Paraldehyd (2) bekannt sind. Die beiden vorigen stehen im Gleichgewicht mit ihren jeweiligen Konformationsisomeren (4) bzw. (3), die allerdings aus sterischen Gründen, da sich hier die Methylgruppen gegenseitig behindern würden, sehr instabil sind.[14][15]
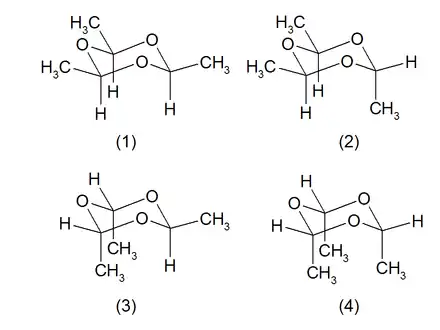
Sicherheitstechnische Kenngrößen
Paraldehyd bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 27 °C.[1] Der Explosionsbereich liegt zwischen 1,3 Vol.‑% (70 g/m³) als untere Explosionsgrenze (UEG) und 17 Vol.‑% als obere Explosionsgrenze (OEG).[16][1] Die Grenzspaltweite wurde mit 1,01 mm bestimmt.[1][16] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1] Die Zündtemperatur beträgt 201 °C.[1][16] Der Stoff fällt somit in die Temperaturklasse T3.
Sicherheitshinweise
Die Lagerung ist auf Grund der Instabilität schwierig. Man setzt ein Antioxidans zu und lagert fern von Licht und Wärme bzw. in Braunglasflaschen. Die angebrochenen Mengen sollten möglichst klein gehalten und schnell verbraucht werden.
Nachweis
- Der Aldehyd reagiert in der Tollensprobe mit einem Silberdiamminkomplex und bildet einen Silberspiegel aus elementarem Silber.
- In der Iodoformreaktion lässt sich die CH3-CO-Gruppe nachweisen.
Für beide Reaktionen ist eine saure Hydrolyse des Paraldehyds zu Acetaldehyd erforderlich.
Paraldehyd wird in Arzneibüchern monographiert.
Siehe auch
Einzelnachweise
- Eintrag zu 2,4,6-Trimethyl-1,3,5-trioxan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Juni 2020. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-410.
- Datenblatt Paraldehyde bei Sigma-Aldrich, abgerufen am 18. April 2011 (PDF).
- Eintrag zu 2,4,6-trimethyl-1,3,5-trioxane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Paraldehyd (PDF) bei Merck, abgerufen am 18. Januar 2011.
-
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 16.
- H.P. Latscha; U. Kazmaier; H.A. Klein: Chemie für Biologen, Springer Verlag 2005, ISBN 3-540-21161-6, S. 515.
- M. Eckert, G. Fleischmann, R. Jira, H.M. Bolt, K. Golka: Acetaldehyd, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a01_031.pub2.
- Pihlaja, K.; Tuomi, M.: Bond-Bond interactions in organic oxygen compounds. Part II. Anomalous stablization in cis-2,4,6-trimethyl-1,3,5-trioxane in Suom. Kemistil. 43 (1970) 224–226.
- Clegg, G.A.; Melia, T.P.: Thermodynamics of polymerization of heterocyclic compounds. Part IV. The heat capacity, entropy, enthalpy and free energy of paraldehyde in Makromol. Chem. 123 (1969) 194–202.
- Hollmann, R.: Physical and natural equilibria between the modifications of aldehyde in Z. Phys. Chem., Stoechiom. Verwandtschaftsl. 43 (1903) 129–159.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. in : J. Phys. Chem. Ref. Data 25, 1996, S. 1–525; doi:10.1063/1.555985.
- R. M. Stephenson, S. Malanowski: Handbook of the Thermodynamics of Organic Compounds. Springer 1987, ISBN 94-010-7923-4, doi:10.1007/978-94-009-3173-2.
- Kewley, R.: Microwave spectrum of paraldehyde. In: Canadian Journal of Chemistry. 48 (5), 1970, S. 852–855, doi:10.1139/v70-136.
- D. C. Carpenter, L. O. Brockway: The Electron Diffraction Study of Paraldehyde. In: Journal of the American Chemical Society. 58, 1936, S. 1270–1273, doi:10.1021/ja01298a053.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
