Natriumtriacetoxyborhydrid
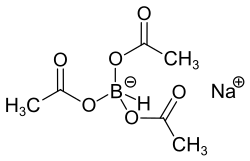
Natriumtriacetoxyborhydrid ist eine chemische Verbindung mit der Formel Na(CH3COO)3BH. Dabei bilden Acetatgruppen mit der B–H-Gruppe zusammen das Anion. Wie andere Borhydride auch wird es als Reduktionsmittel in der organischen Chemie verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumtriacetoxyborhydrid | ||||||||||||||||||
| Summenformel | C6H10BNaO6 | ||||||||||||||||||
| Kurzbeschreibung |
feinkristallines weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 212,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,36 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
111 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften und Synthese
Es ist ein farbloses Salz und kann durch Umsetzung von Natriumborhydrid mit Essigsäure hergestellt werden:[2]
Vergleich mit ähnlichen Reduktionsmitteln
Natriumtriacetoxyborhydrid ist ein milderes Reduktionsmittel als Natriumborhydrid oder Natriumcyanoborhydrid. Es reduziert Aldehyde, aber die meisten Ketone bleiben unberührt. Besonders geeignet ist es für die reduktive Aminierung von Aldehyden oder Ketonen.[3][4][5] Allerdings wird Natriumtriacetoxyborhydrid im Gegensatz zu Natriumcyanoborhydrid einfacher hydrolysiert und ist somit auch nicht mit Methanol kompatibel. Es reagiert aber nur langsam mit Ethanol und Isopropanol und kann daher stattdessen mit diesen Lösungsmitteln benutzt werden.[4]
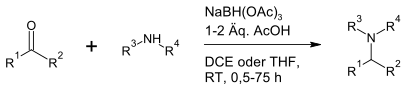
NaBH(OAc)3 kann auch für die reduktive Alkylierung von sekundären Aminen mit Aldehyd-Bisulfit-Addukten benutzt werden.[6]
Monoacetoxyborhydrid
Bei der Reaktion von Natriumborhydrid mit Carbonsäuren entstehen neben Tricarboxylatborhydrid auch Di- und Monocarboxylatborhydride. Manche davon sind in der Lage, Reduktionen auszuführen, welche atypisch für Borhydrid-Chemie sind. Beispielsweise können dabei Alkohole zu Kohlenwasserstoffen und Nitrile zu primären Aminen reduziert werden.[7]
Siehe auch
- Natriumcyanoborhydrid – ein etwas stärkeres Reduktionsmittel, aber instabil in protischen Lösungsmitteln.
- Natriumborhydrid – ein billigeres, stärkeres Reduktionsmittel.
Einzelnachweise
- Datenblatt Natriumtriacetoxyborhydrid bei Sigma-Aldrich, abgerufen am 26. Dezember 2021 (PDF).
- Gordon W. Gribble, Ahmed F. Abdel-Magid: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2007, ISBN 978-0-470-84289-8, Sodium Triacetoxyborohydride, doi:10.1002/047084289x.rs112.pub2.
- A.F. Abdel-Magid, K. G. Carson, B. D. Harris, C. A. Maryanoff, R. D. Shah: Reductive Amination of Aldehydes and Ketones with Sodium Triacetoxyborohydride. Studies on Direct and Indirect Reductive Amination Procedures1. In: The Journal of Organic Chemistry. Band 61, Nr. 11, 1996, S. 3849–3862, doi:10.1021/jo960057x.
- A. F. Abdel-Magid, S. J. Mehrman: A Review on the Use of Sodium Triacetoxyborohydride in the Reductive Amination of Ketones and Aldehydes. In: Organic Process Research & Development. Band 10, Nr. 5, 2006, S. 971, doi:10.1021/op0601013.
- J. Magano, E. J. Kiser, R. J. Shine, M. H. Chen: Oxindole Synthesis via Palladium-catalyzed C-H Functionalization. In: Organic Syntheses. Band 90, 2013, S. 74, doi:10.15227/orgsyn.090.0074.
- Chennagiri R. Pandit, Neelakandha S. Mani: Expedient Reductive Amination of Aldehyde Bisulfite Adducts. In: Synthesis. Band 2009, Nr. 23, 2009, S. 4032–4036, doi:10.1055/s-0029-1217050.
- G. W. Gribble: Sodium borohydride in carboxylic acid media: a phenomenal reduction system. In: Chemical Society Reviews. Band 27, Nr. 6, 1998, S. 395, doi:10.1039/A827395Z.



