Guerbet-Kondensation
Die Guerbet-Kondensation – auch Guerbet-Reaktion – ist eine Namensreaktion aus dem Bereich der Organischen Chemie, die 1899 erstmals durch den französischen Chemiker Marcel Guerbet (1861–1938) publiziert wurde.[1] Bei der Guerbet-Kondensation werden primäre oder sekundäre Alkohole bei hohen Temperaturen und hohem Druck in Gegenwart von Alkalimetallhydroxiden oder Alkoxiden über Aldehyde und Aldolprodukte zu längerkettigeren Alkoholen, in diesem Zusammenhang auch Guerbet-Alkohole genannt, umgesetzt.[2][3][4]
Übersicht
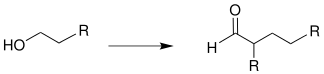
Die Guerbet-Kondensation lässt sich in die Bildung des höherwertigen Aldehyds und die anschließende Cannizzaro-Reaktion unterteilen.
Im ersten Teil der Reaktion wird ein primärer Alkohol (alternativ: sekundärer Alkohol) unter anderem über eine Aldolkondensation zu einem Aldehyd umgesetzt.
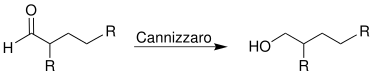
Im zweiten Teil der Reaktion wird der entstandene Aldehyd in einer Cannizzaro-Reaktion zu einem Guerbet-Alkohol umgesetzt, der nun höherwertig ist als der Alkohol, der als Edukt eingesetzt wurde.
Neben dem Guerbet-Alkohol entsteht zu gleichen Teilen das identisch substituierte Carboxylat.
Reaktionsmechanismus
Der Reaktionsmechanismus besteht aus der Bildung des Aldehyds und der anschließenden Bildung des Guerbet-Alkohols.
Bildung des Aldehyds
Ein Vorschlag für den Reaktionsmechanismus der Bildung des Aldehyds:[6][7]
Zunächst wird ein primärer Alkohol (alternativ: sekundärer Alkohol) deprotoniert. Dadurch bildet sich an dieser Stelle eine Carbonylgruppe aus und das Wasserstoffatom der Hydroxygruppe wird als Hydrid-Ion abgespalten. Dieses Hydrid-Ion deprotoniert den entstandenen Aldehyd 1 in α-Position, ein Wasserstoffmolekül wird abgespalten und es entsteht der in α-Position deprotonierte Aldehyd 2. Auf weitere mesomere Grenzstrukturen (Hinweis: Keto-Enol-Tautomerie) wurde zwecks besserer Übersicht verzichtet. Durch eine Aldolkondensation dieses Ions 2 mit dem Aldehyd 1 entsteht das Alkenal (α,β-ungesättigter Aldehyd) 3. Durch Addition eines Hydrid-Ions in α-Position entsteht eine negative Ladung am β-Kohlenstoffatom des Alkenals 3. An dieser Stelle wird anschließend ein Proton addiert. So entsteht der Aldehyd 6.[6][7] Dabei entsteht außerdem der Aldehyd 5, der identisch ist mit dem Aldehyd 1 und ebenfalls eine Aldolkondensation mit dem Anion 2 eingehen kann.
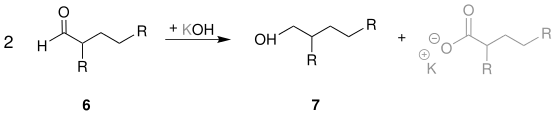
Bildung des Guerbet-Alkohols
Abschließend wird in einer Cannizzaro-Reaktion durch Reaktion zweier Moleküle des Aldehyds 6 mit einem Hydroxid-Ion unter Abspaltung eines Carboxylat-Ions (grau) der Alkohol 7 (Guerbet-Alkohol) synthetisiert:[6]
Alternativ kann der gebildete Aldehyd oxidiert werden um quantitativ die entsprechende Carbonsäure zu erhalten. Auf diese Weise sind bisubstituierte Essigsäuren mit dem Substitutionsschema Cn und Cn+2 erhältlich.
Einzelnachweise
- M. Guerbet: Action de l'alcool amylique de fermentation sur son dérivé sodé. In: Comptes rendus de l’Académie des sciences. Band 128, 1899, S. 511–513 (Digitalisat auf Gallica).
- Robert Miller, George Bennett: Producing 2-Ethylhexanol by the Guerbet Reaction. In: Industrial & Engineering Chemistry. Band 53, Nr. 1, 1. Januar 1961, S. 33–36, doi:10.1021/ie50613a027.
- Ch. Weizmann, E. Bergmann, M. Sulzbacher: Further Observations on the Guerbet Reaction. In: The Journal of Organic Chemistry. Band 15, Nr. 1, 1. Januar 1950, S. 54–57, doi:10.1021/jo01147a010.
- Ramesh Varadaraj, Jan Bock, Paul Valint, Stephen Zushma, Robert Thomas: Fundamental interfacial properties of alkyl-branched sulfate and ethoxy sulfate surfactants derived from Guerbet alcohols. 1. Surface and instantaneous interfacial tensions. In: The Journal of Physical Chemistry. Band 95, Nr. 4, 1. Februar 1991, S. 1671–1676, doi:10.1021/j100157a033.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, John Wiley & Sons, Hoboken, New Jersey, 2009, ISBN 978-0-471-70450-8, S. 1298.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, John Wiley & Sons, Hoboken, New Jersey, 2009, ISBN 978-0-471-70450-8, S. 1299.
- S. Veibel, J. I. Nielsen: On the mechanism of the Guerbet reaction. In: Tetrahedron. Band 23, Nr. 4, 1967, S. 1723–1733, doi:10.1016/S0040-4020(01)82571-0.