1,2-Diaminocyclohexan
1,2-Diaminocyclohexan ist eine chemische Verbindung. Sie besteht aus einem Cyclohexanring als Grundgerüst, an dem zwei Aminogruppen an benachbarten Kohlenstoffatomen gebunden sind und gehört somit zur Gruppe der Diamine.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
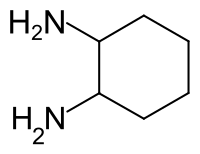 | |||||||||||||||||||
| Strukturformel von 1,2-Diaminocyclohexan ohne Angabe der Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,2-Diaminocyclohexan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H14N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aminartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,95 g·cm−3[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Isomerie
1,2-Diaminocyclohexan enthält zwei stereogene Zentren, folglich gibt es drei Stereoisomere: (R,R)-1,2-Diaminocyclohexan und das dazu spiegelbildliche (S,S)-1,2-Diaminocyclohexan sowie meso-1,2-Diaminocyclohexan. Das 1:1-Gemisch aus (R,R)- und der enantiomeren (S,S)-Form ist das Racemat trans-1,2-Diaminocyclohexan. meso-1,2-Diaminocyclohexan wird bisweilen auch cis-1,2-Diaminocyclohexan genannt.
| Stereoisomere von 1,2-Diaminocyclohexan | |||
| Name | (S,S)-1,2-Diaminocyclohexan | (R,R)-1,2-Diaminocyclohexan | (R*,S*)-1,2-Diaminocyclohexan |
| Andere Namen | trans-(+)-1,2-Diaminocyclohexan | trans-(–)-1,2-Diaminocyclohexan | cis-1,2-Diaminocyclohexan meso-1,2-Diaminocyclohexan |
| Strukturformel | -1%252C2-Diaminocyclohexane.svg.png.webp) | -1%252C2-Diaminocyclohexane.svg.png.webp) | 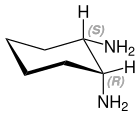 |
| CAS-Nummer | 21436-03-3 | 20439-47-8 | 1436-59-5 |
| 694-83-7 (unspez.) | |||
| EG-Nummer | – | – | – |
| 606-765-2 (unspez.) | |||
| ECHA-Infocard | 100.127.756 | 100.111.336 | 100.117.844 |
| 100.010.707 (unspez.) | |||
| PubChem | 479307 | 43806 | 342917 |
| 4610 (unspez.) | |||
| Wikidata | Q161459 | Q15605490 | Q15605498 |
| Q27165475 (unspez.) | |||
Darstellung
1,2-Diaminocyclohexan kann durch einen Curtius-Abbau von 1,2-Cyclohexandicarbonsäure hergestellt werden.[3] Wird die trans-1,2-Cyclohexandicarbonsäure als Edukt verwendet, sind die Aminogruppen im Produkt ebenfalls trans-ständig angeordnet. Ausgehend von cis-1,2-Cyclohexandicarbonsäure (meso-1,2-Cyclohexandicarbonsäure) erhält man analog cis-1,2-Diaminocyclohexan (meso-1,2-Diaminocyclohexan). Die Racematspaltung von trans-1,2-Diaminocyclohexan [1:1-Gemisch aus (R,R)-1,2-Diaminocyclohexan und (S,S)-1,2-Diaminocyclohexan] in seine Enantiomere lässt sich über diastereomere Salze durch die Behandlung mit enantiomerenreiner Weinsäure bewerkstelligen.[4]
Das cis-1,2-Diaminocyclohexan (in Form seines Sulfat-Salzes) lässt sich aus dem Isomerengemisch durch Umsetzung mit Nickelchlorid und anschließender Behandlung mit Schwefelsäure und Ethanol gewinnen.[5]
Eigenschaften
Es handelt sich um eine farblose bei Raumtemperatur flüssige Verbindung, die bei 183 °C siedet. Der Drehwert der reinen Substanz bei 55 °C und einer Wellenlänge von 589 nm beträgt −36° [(R,R)-Enantiomer].[4]
Verwendung
Durch Kondensationsreaktionen mit α,β-Diketonen kann 1,2-Diaminocyclohexan zur Synthese von Pyrazinen benutzt werden. Unter Abspaltung von zwei Wassermolekülen werden so zunächst Diimine erhalten, die dann zu Pyrazinen oxidiert werden können.
Durch Kondensation mit aktivierten Carbonsäuren (Steglich-Veresterung) oder Carbonsäurechloriden können Amide hergestellt werden. Diese Reaktion wird beispielsweise zur Synthese des Trost-Liganden eingesetzt.[6]
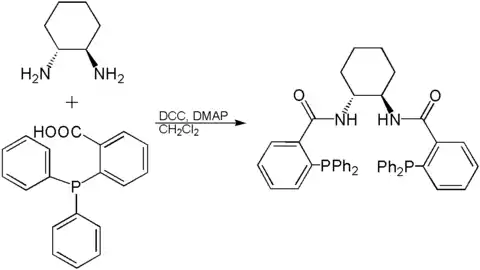
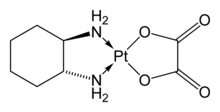
In der Komplexchemie kann 1,2-Diaminocyclohexan als zweizähniger Chelatligand eingesetzt werden. So sind beispielsweise Oxaliplatinverbindungen, die als Zytostatika eingesetzt werden, Platinkomplexe des 1,2-Diaminocyclohexans.
Außerdem kondensiert 1,2-Diaminocyclohexan mit zwei Äquivalenten eines Salicylaldehyd-Derivats zu einem Salen-Liganden.[7] Diese vierzähnigen Chelatliganden bilden mit Cobalt(II) Komplexe, die als Sauerstofftransporter beispielsweise bei der Jacobsen-Epoxidierung Verwendung finden.
Einzelnachweise
- Datenblatt 1,2-Diaminocyclohexan (PDF) bei Merck, abgerufen am 18. Januar 2011.
- Eintrag zu Cyclohex-1,2-ylendiamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Heinrich Otto Wieland, Otto Schlichting, Werner von Langsdorff: Untersuchungen über die Gallensäuren. XXV. Mitteilung. Studien zum Abbau von Dicarbonsäuren. In: Hoppe-Seyler's Zeitschrift für physiologische Chemie, Bd. 161 (1926), S. 74–79. doi:10.1515/bchm2.1926.161.1-3.74
- F. M. Jaeger, Lucas Bijkerk: Über komplexe Salze des dreiwertigen Kobalts, Chroms und Rhodiums mit razemischen und optisch-aktiven trans-Cyclohexan-l,2-Diaminen. In: Zeitschrift für anorganische und allgemeine Chemie, Bd. 233 (1937), S. 97–139. doi:10.1002/zaac.19372330202.
- Prisca K. Eckert, Verena Schill, Carsten Strohmann: Synthesis of cis-TMCDA: Optimization and characterization of a key intermediate. In: Inorganica Chimica Acta. 2011, doi:10.1016/j.ica.2011.06.008.
- Bernhard Johannes Lüssem: Palladium-katalysierte enantioselektive Synthese allylischer Thiocarboxylate und Palladium-katalysierte Deracemisierung allylischer Carbonate (PDF; 7,8 MB). Dissertation, RWTH Aachen 2004.
- Konstantin P. Bryliakov, Evgenij P. Talsi: Titanium-Salan-Catalyzed Asymmetric Oxidation of Sulfides and Kinetic Resolution of Sulfoxides with H2O2 as the Oxidant In: European Journal of Organic Chemistry, Jg. 11 (2008), S. 3369–3376, doi:10.1002/ejoc.200800277.

