Diazine
Diazine sind heterocyclische aromatische chemische Verbindungen. Sie gehören zu den organischen Verbindungen und besitzen ein sechsgliedriges Ringsystem, das als Heteroatome zwei Stickstoffatome beinhaltet, und zählen damit zu den Azinen.
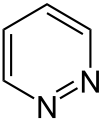 Pyridazin
Pyridazin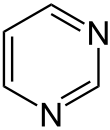 Pyrimidin
Pyrimidin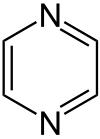 Pyrazin
Pyrazin
Die Bezeichnung Diazine lässt sich aus der systematischen Hantzsch-Widman-Nomenklatur ableiten.[1]
Es können drei isomere Stammsysteme formuliert werden – Pyridazin (1,2-Diazin), Pyrimidin (1,3-Diazin) und Pyrazin (1,4-Diazin) – deren allgemeine Summenformel C4H4N2 lautet.
Vorkommen
Diazine sind in einer Reihe von Naturstoffen zu finden.[2] So besitzen beispielsweise die Nukleinbasen der DNA und der RNA ein Purin- beziehungsweise Pyrimidingerüst.
Herstellung
Pyridazine
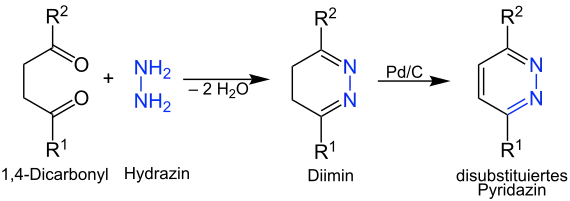
Zur Herstellung von Pyridazinen kann eine zweifache Kondensationsreaktion genutzt werden. Hierzu wird eine 1,4-Dicarbonylverbindung mit Hydrazin umgesetzt. Hydrazin kondensiert hierbei stufenweise unter Abspaltung je eines Teilchen Wassers an die Carbonylfunktionen. Das hieraus gebildete Diimin kann nun beispielsweise am Palladium-Aktivkohle-Katalysator dehydriert werden und aromatisiert werden.[3]
Pyrimidine
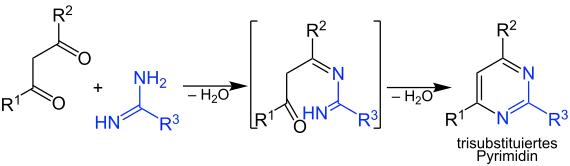
Pyrimidine lassen sich aus der säurekatalysierten Reaktion von 1,3-Dicarbonylverbindungen mit Amidinen gewinnen.[4] Im ersten Schritt kondensiert die Aminofunktion an ein Keton. Der zweite Schritt besteht aus einer weiteren Kondensation mit anschließender Aromatisierung, wobei der Ring gebildet wird. In beiden Kondensationsschritten wird je ein Teilchen Wasser abgespalten. Zu dieser Reaktion sowohl Ketone als auch Aldehyde als Carbonylkomponenten eingesetzt werden.[5]
Eigenschaften
Diazine gehören zur Gruppe der aromatischen Stickstoffbasen. Die zwei Stickstoffatome verringern die Elektronendichte im Ringsystem so stark, dass an ihnen elektrophile aromatische Substitutionen oftmals nur schlecht oder gar nicht ablaufen. Die Bereitschaft zur elektrophilen Substitution kann durch die Einführung elektronenschiebender Substituenten gesteigert werden.[8]
Einzelnachweise
- D. Hellwinkel: Die systematische Nomenklatur der Organischen Chemie, 4. Auflage, Springer Verlag, Berlin, 1998, ISBN 3-540-63221-2.
- Eintrag zu Diazine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- S. Brooker, R. J. Kelly: Synthesis and structure of dilead(II) and dimanganese(II) complexes of macrocycles derived from 3,6-diformylpyridazine, in: J. Chem. Soc. Dalton Trans. 1996, 10, 2117–2122; doi:10.1039/DT9960002117.
- H. P. Latscha, U. Kazmaier, H. A. Klein: Organische Chemie: Chemie-Basiswissen II, S. 322–323, 6. Auflage, Springer Verlag Berlin, 2008, ISBN 3-540-77106-9.
- D. T. Davies: Basistexte Chemie: Aromatische Heterocyclen. VCH-Wiley, 1995, ISBN 3-527-29289-6, S. 73–77.
- C. Neuberg: Reduktion von Aminosäuren zu Aminoaldehyden, in: Ber. d. Dt. Chem. Ges. 1908, 41, S. 956–963; doi:10.1002/cber.190804101185.
- C. Stoehr: Ueber Pyrazine und Piperazine, in: J. Prakt. Chem. 1893, 47, S. 439–522; doi:10.1002/prac.18930470137.
- J. A. Joules, K. Mills: Heterocyclic Chemistry. 5. Auflage, Blackwell Publishing, Chichester 2010, ISBN 978-1-405-19365-8, S. 250–288.