Jacobsen-Epoxidierung
Die Jacobsen-Epoxidierung (Jacobsen-Katsuki-Epoxidierung) ist eine Namensreaktion aus dem Bereich der organischen Chemie. Sie wurde, unabhängig voneinander, von den Chemikern Eric N. Jacobsen[1][2] und Tsutomu Katsuki[3][4] entdeckt.
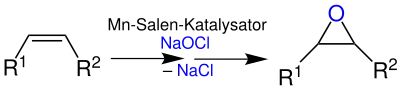
Die Jacobsen-Epoxidierung ist eine enantioselektive Methode, um asymmetrische Epoxide aus den entsprechenden Alkenen zu synthetisieren. Für die Reaktion werden ein chiraler Mangan(III)-Salen-Komplex als Katalysator, sowie stöchiometrische Mengen eines Oxidationsmittels (z. B. Natriumhypochlorit) benötigt. Im Gegensatz zur Sharpless-Epoxidierung ist sie nicht auf Allylalkohole beschränkt, sondern allgemein bei mehrfach substituierten, nicht aktivierten Alkenen anwendbar.[5]
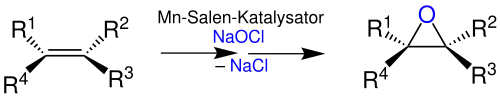
Besonderes Merkmal der Jacobsen-Epoxidierung ist die hohe Enantioselektivät. Beste Ergebnisse konnten dabei mit cis-Alkenen als Edukt erzielt werden. Je nach Reaktionsbedingungen sind jedoch auch trans-Alkene und höher substitituierte Alkene als Edukte möglich. Gerade für die Darstellung höher substituierter Epoxide empfiehlt sich der Zusatz von N-Oxiden.[6]
Struktur des Katalysators
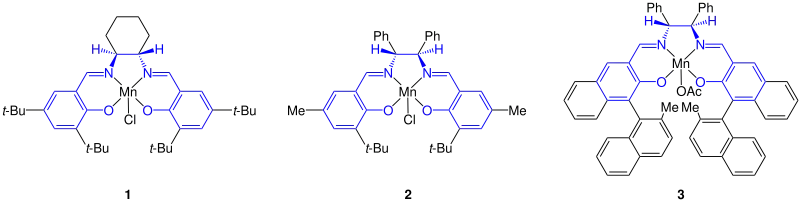
Kern der Jacobsen-Epoxidierung ist der Mangan(III)-Salen-Katalysator. Die von Jacobsen entwickelten Katalysatoren (1 und 2; t-Bu = tert-Butyl, Me = Methyl, Ph = Phenyl) sowie der von Katsuki vorgeschlagene Katalysator (3; Me = Methyl, Ac = Acetyl, Ph = Phenyl) unterscheiden sich dabei in den Liganden am Salen-Skelett und am Mangan:[7]
Die hohe Enantioselektivität der Jacobsen-Epoxidierung lässt sich an einem Beispiel zeigen. Entscheidend für die Konfiguration des gebildeten Epoxids ist dabei die Konfiguration des Katalysators:[2]
| Edukt | Chiraler Katalysator | Produkt | Enantioselektivität in ee |
|---|---|---|---|
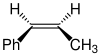 |
(S,S)-Katalysator (1) |  |
92 % |
| (R,R)-Katalysator (2) |  |
84 % | |
Reaktionsmechanismus
Für die Epoxidierung muss der Katalysator zunächst durch das Oxidationsmittel – hier Natriumhypochlorit – in die reaktive Mangan(V)-Form überführt werden:
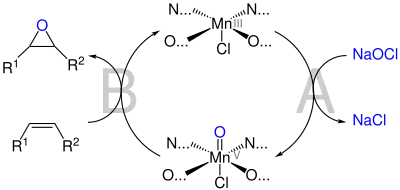
Während über die Oxidation (A) des Katalysators in der Literatur Konsens herrscht, sind die weiteren mechanistischen Details (B) der Jacobsen-Epoxidierung noch umstritten:[7][8][9]

Alkylsubstituierte Alkene bilden vornehmlich cis-Epoxide, weshalb für diese ein konzertierter Mechanismus vorgeschlagen wird.
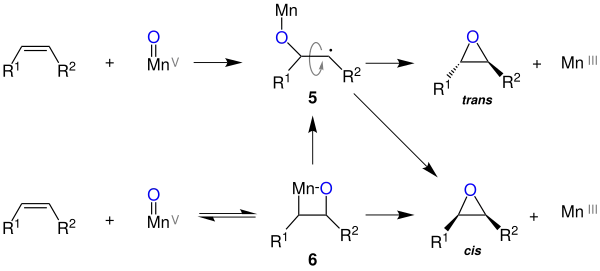
Konjugierte Alkene bilden jedoch vornehmlich trans-Epoxide, weshalb hier ein radikalischer Mechanismus vermutet wird. Die freie Drehbarkeit des radikalischen Zwischenproduktes (5) ermöglicht dabei die Bildung des trans-Produktes. Ein dritter Mechanismus über die Zwischenstufe eines Mangano-Oxetans (6) könnte die Bildung beider Isomere erklären. Dieses Zwischenprodukt kann direkt zum cis-Epoxid reagieren, oder aber durch Homolyse zum radikalischen Zwischenprodukt (5) reagieren, wodurch auch trans-Epoxide entstehen können.
Einzelnachweise
- W. Zhang, J. L. Loebach, S. R. Wilson & E. N. Jacobsen: Enantioselective epoxidation of unfunctionalized olefins catalyzed by salen manganese complexes. In: Journal of the American Chemical Society. Band 112, Nr. 7, März 1990, S. 2801–2803, doi:10.1021/ja00163a052.
- Eric N. Jacobsen, Wei Zhang, Alexander R. Muci, James R. Ecker, Li Deng: Highly enantioselective epoxidation catalysts derived from 1,2-diaminocyclohexane. In: Journal of the American Chemical Society. Band 113, Nr. 18, 1991, S. 7063–7064, doi:10.1021/ja00018a068.
- Ryo Irie, Keiko Noda, Yoshio Ito, Naohide Matsumoto, Tsutomu Katsuki: Catalytic asymmetric epoxidation of unfunctionalized olefins using chiral (salen)manganese(III) complexes. In: Tetrahedron: Asymmetry. Band 2, Nr. 7, 1991, S. 481–494, doi:10.1016/S0957-4166(00)86102-9.
- Tsutomu Katsuki: Catalytic asymmetric oxidations using optically active (Salen)manganese(III) complexes as catalysts. In: Coordination Chemistry Reviews. Band 140, Februar 1995, S. 189–214, doi:10.1016/0010-8545(94)01124-T.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage. Wiesbaden 2005, S. 622.
- Bridget D. Brandes, Eric N. Jacobsen: Highly Enantioselective, Catalytic Epoxidation of Trisubstituted Olefins. In: The Journal of Organic Chemistry. Band 59, Nr. 16, 1994, S. 4378–4380, doi:10.1021/jo00095a009.
- Torsten Linker: Jacobsen-Katsuki epoxidation and its controversial mechanism. In: Angew. Chem. Int. Ed. Engl. Band 36, Nr. 19, 1997, S. 2060–2062, doi:10.1002/anie.199720601.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, ISBN 978-0-12-429785-2, S. 222–223.
- Christian Linde, Moritz Arnold, Per-Ola Norrby, Björn Akermark: Gibt es eine radikalische Zwischenstufe bei der Mangan(salen)-katalysierten Epoxidierung von Alkenen? In: Angew. Chem. Band 106, Nr. 16, 1997, S. 1802–1803, doi:10.1002/ange.19971091615.