Curtius-Reaktion
Die Curtius-Reaktion (auch Curtius-Abbau bzw. Curtius-Umlagerung) ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Sie tritt beim Erhitzen von Carbonsäureaziden R–CO–N3 ein und ist eng verwandt mit dem Lossen-Abbau, dem Hofmann-Amid-Abbau und der Schmidt-Reaktion. Die Reaktion wird vor allem verwendet, um Carbonsäuren zu primären Aminen abzubauen, es können jedoch auch je nach Reaktionsbedingungen Isocyanate, Carbamate oder Harnstoff-Derivate erhalten werden. Die Reaktion ist benannt nach ihrem Entdecker, dem deutschen Chemiker Theodor Curtius (1857–1928).[1][2][3]

Übersicht
Übersichtsreaktion
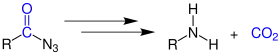
Durch die Curtius-Reaktion wird ein Carbonsäureazid, über die Zwischenstufe des Isocyanats, mit Wasser zum primären Amin umgesetzt.[4] Das so dargestellte Amin ist um ein Kohlenstoff-Atom kürzer als das verwendete Carbonsäureazid, daher spricht man auch vom Curtius-Abbau:[5]
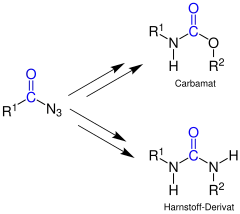
Anstelle von Wasser kann die Curtius-Reaktion auch mit anderen Nukleophilen erfolgen. Durch Umsetzung mit einem Alkohol (R2OH) entsteht ein Carbamat, mit einem Amin (R2NH2) ein Derivat des Harnstoffs:
Wird die Curtius-Umlagerung in Anwesenheit von tert-Butanol durchgeführt, werden Butyloxycarbonyl- (Boc)-geschützte Amine erhalten und in Anwesenheit von Benzylalkohol entsprechend die Benzyloxycarbonyl- (Cbz)-geschützten Amine.[6]
Darstellung des Carbonsäureazids
Die für die Curtius-Reaktion als Edukt benötigten Carbonsäureazide werden meist aus Carbonsäuren oder Carbonsäurederivaten (Carbonsäurechloride oder Carbonsäurehydrazide) synthetisiert.[7] Alternativ können Carbonsäureazide durch Umsetzung der Carbonsäure mit Diphenylphosphorylazid oder mit Chlorameisensäureethylester über ein gemischtes Anhydrid erhalten werden.[3][8][9][10]
Reaktionsmechanismus
Durch Hitzezufuhr lagert sich das Carbonsäureazid 1 in einer konzertierten Reaktion zum Isocyanat 2 um.[5] Dabei wird molekularer Stickstoff freigesetzt. Die häufig als kurzlebige Zwischenprodukte formulierten Nitrene treten wahrscheinlich nicht auf. Bei Durchführung in einem inerten Lösungsmittel bleiben die Isocyanate Endprodukt der Reaktion, während sie in Gegenwart von Wasser zur entsprechenden Carbaminsäure 3 weiterreagieren, die unmittelbar decarboxyliert und als Endprodukt das primäre Amin 4 ergibt.[3][11]

Die Reaktion des Isocyanats 2 mit Alkoholen oder Aminen erfolgt analog zur Bildung der Carbaminsäure 3. Durch Umsetzung mit tert-Butanol entsteht ein Boc-geschütztes Amin 5:

Literatur
- Peter A. S. Smith: The Curtius Reaction. In: Organic Reactions. 3, Nr. 9, 1946, S. 337–449, doi:10.1002/0471264180.or003.09.
- Eric F. V. Scriven, Kenneth Turnbull: Azides: their preparation and synthetic uses. In: Chemical Reviews. 88, Nr. 2, 1988, S. 297–368, doi:10.1021/cr00084a001.
Einzelnachweise
- Th. Curtius: Ueber Stickstoffwasserstoffsäure (Azoimid) N3H. In: Berichte der deutschen chemischen Gesellschaft. 23, Nr. 2, 1890, S. 3023–3033, doi:10.1002/cber.189002302232.
- Th. Curtius: 20. Hydrazide und Azide organischer Säuren I. Abhandlung. In: Journal für Praktische Chemie. 50, Nr. 1, 1894, S. 275–294, doi:10.1002/prac.18940500125.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, ISBN 0-12-369483-3.
- Kaiser, C.; Weinstock, J.: Amines from mixed carboxylic-carbonic anhydrides: 1-phenylcyclopentylamine In: Organic Syntheses. 51, 1971, S. 48, doi:10.15227/orgsyn.051.0048; Coll. Vol. 6, 1988, S. 910 (PDF).
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Springer Spektrum, Berlin und Heidelberg 2004. S. 623–626, ISBN 978-3-662-45683-5.
- Hélène Lebel, Olivier Leogane: Boc-Protected Amines via a Mild and Efficient One-Pot Curtius Rearrangement. In: Organic Letters. 7, Nr. 19, 2005, S. 4107–4110, doi:10.1021/ol051428b.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 416 und 426, ISBN 3-342-00280-8.
- Shioiri, T.; Yamada, S.: Diphenyl phosphorazidate In: Organic Syntheses. 62, 1984, S. 187, doi:10.15227/orgsyn.062.0187; Coll. Vol. 7, 1990, S. 206 (PDF).
- Takayuki Shioiri, Kunihiro Ninomiya, Shunichi Yamada: Diphenylphosphoryl azide. New convenient reagent for a modified Curtius reaction and for peptide synthesis. In: Journal of the American Chemical Society. 94, Nr. 17, 1972, S. 6203–6205, doi:10.1021/ja00772a052.
- K. Ninomiya, T. Shioiri, S. Yamada: Phosphorus in organic synthesis—VII : Diphenyl phosphorazidate (DPPA). A new convenient reagent for a modified curtius reaction. In: Tetrahedron. 30, Nr. 14, 1974, S. 2151–2157, doi:10.1016/S0040-4020(01)97352-1.
- Peter Sykes: Reaktionsmechanismen – eine Einführung. 8. Auflage, VCH, Weinheim 1982, ISBN 3-527-21090-3, S. 140.