1,12-Dodecandisäure
1,12-Dodecandisäure, englisch 1,12-dodecanedioic acid (DDDA), ist eine längerkettige lineare Dicarbonsäure mit endständigen Carboxygruppen, die sich wegen ihrer hydrophoben Eigenschaften insbesondere als Monomerbaustein für Polyester und Polyamide mit geringer Wasseraufnahme eignet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | 1,12-Dodecandisäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H22O4 | |||||||||||||||
| Kurzbeschreibung |
weißes Pulver oder Schuppen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 230,31 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
205 °C (1 hPa)[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
0,04 g/l in Wasser bei 20 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
1,12-Dodecandisäure wird großtechnisch über eine dreistufige Reaktionsfolge, ausgehend von dem einfach aus 1,3-Butadien zugänglichen 1,5,9-Cyclododecatrien (CDT) hergestellt.[4][5][6]
Zunächst wird CDT in Gegenwart von Raney-Nickel zu bei 200 °C und 10–15 bar Druck praktisch quantitativ zu Cyclododecan (CDAN) hydriert, das anschließend mit Luft oder Sauerstoff in Gegenwart von Borsäure bei 150–160 °C und Normaldruck oxidiert wird (Bashkirov-Oxidation[7]).
Dabei reagiert das entstehende Cyclododecanol (CDOL) zum Cyclododecantriborat und wird dadurch der weiteren Oxidation zum Cyclododecanon (CDON) entzogen. Nach Hydrolyse des Triborats wird das sogenannte Ol-On-Gemisch mit einer Zusammensetzung von 80 bis 90 % CDOL und 10–20 % CDON erhalten.
Wegen der geringen Selektivität der Oxidationsreaktion wird der Reaktionsumsatz unter 30 % gehalten.[7]
Anschließend wird das erhaltene Ol-On-Gemisch entweder direkt oder nach Dehydrierung zum CDON mit Salpetersäure und Essigsäure als Lösungsvermittler in Ausbeuten von ca. 75 % d.Th. zu 1,12-Dodecandisäure oxidiert.[8]
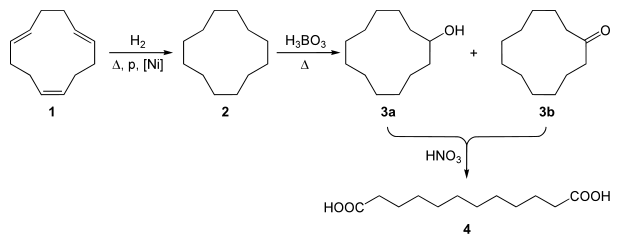
Die mit Kupferpulver und Ammoniummetavanadat katalysierte Oxidation des Ol-On-Gemischs mit 60%iger Salpetersäure bei Temperaturen von 85 bis 95 °C liefert DDDA in einer Ausbeute von 84 % d.Th.[9]
Die geringen Selektivitäten der beschriebenen Oxidationsreaktionen haben zu einer intensiven Suche nach Alternativrouten geführt, die entweder die Luftoxidation von Cyclododecan zum Ol-On-Gemisch umgehen, z. B. über die Epoxidierung von CDT[10] oder von Cyclododecen ausgehen, das zum CDOL hydroxyliert wird und weiter zu DDDA oxidiert werden kann.[11]
Cyclododecen kann aber auch direkt durch Ozonolyse mit brauchbaren Ausbeuten (83 % d.Th.) und hoher Reinheit (99 %) in z. B. Propionsäure als inertisierendes Lösungsmittel in 1,12-Dodecadisäure überführt werden.[12][13]
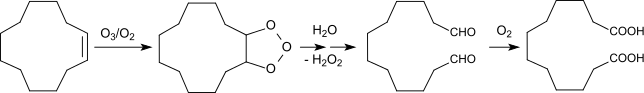
Der bei der Ozonolyse mit einem Ozon-Sauerstoff-Gemisch und anschließender Hydrolyse der Ozonisierungsprodukte hauptsächlich anfallende Dialdehyd Dodecandial wird durch eine oxidativ-thermolytische Nachbehandlung mit dem ozonfreien Sauerstoffstrom zu DDDA oxidiert.
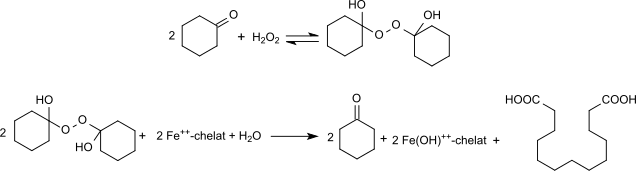
Ein weiterer Syntheseweg basiert auf der Umsetzung von Cyclohexanon mit Wasserstoffperoxid zum Peroxihemiketal des Cyclohexanons und anschließende reduktive Kupplung mit chelatisierten Eisen(II)-salzen in einem wässrig-organischen Phasengemisch. Dabei entsteht DDDA in bis zu 70%iger Ausbeute neben erheblichen Mengen an Capronsäure.[14]
Eine völlig andere Syntheseroute geht von der durch Pyrolyse von Ricinolsäure einfach zugänglichen 10-Undecensäure aus, die in Gegenwart des für industrielle Hydroformylierungen gebräuchlichen Katalysators Carbonylhydridotris(triphenylphosphin)rhodium(I) und Triphenylphosphin zu 11-Formylundecansäure hydroformyliert und anschließend in Gegenwart von Kupfer(II)-acetat und Perpropionsäure mit Sauerstoff in einer Gesamtausbeute von 70 % d.Th. zu 1,12-Dodecandisäure oxidiert wird.[15]
Auf biotechnologischem Wege kann n-Dodecan mit Mutanten der Hefe Candida tropicalis zu DDDA umgesetzt werden.[16][17] Die Oxidation verläuft über die Stufen n-Dodecanol, n-Dodecansäure, 12-Hydroxydodecansäure zu DDDA.
Die aus den nachwachsenden Rohstoffen Kokosöl, Lorbeeröl und Palmöl reichlich zur Verfügung stehende Laurinsäure (Dodecansäure) kann durch ω-Oxidation mithilfe genetisch modifizierter Hefestämme ebenfalls zu DDDA oxidiert werden.[18]
Im Labor kann 1,12-Dodecandisäure auch durch Oxidation von 1,12-Dodecandiol mit starken Oxidationsmitteln, wie z. B. einer alkalischen Lösung von Kaliumpermanganat nach Umkristallisation aus Ethanol/Wasser 1:10 mit einer Reinausbeute von 40 bis 60 % d.Th. erhalten werden.[19]
Hersteller von konventionell erzeugter 1,12-Dodecandisäure sind die Firmen Evonik (DE), Hilead (CN), Invista (USA) und Ube (JP), von biotechnologisch erzeugter DDDA[20] Cathay Industrial Biotech (CN).
Eigenschaften
1,12-Dodecandisäure ist ein weißer kristalliner und geruchloser Feststoff, der sich bei Raumtemperatur nur sehr wenig in Wasser löst. Dagegen ist DDDA in kurzkettigen Alkoholen wie Methanol, Ethanol, Isopropanol, sowie in warmem Cyclohexanol und Cyclohexanon,[14] sowie Aceton löslich.[2]
Die für die Polykondensation zur Erreichung hoher Molmassen von Polyamiden und Polyestern erforderliche hohe Reinheit des Dicarbonsäurebausteins DDDA kann durch Erhitzen in Salpetersäure,[21] mit wässriger Natriumsulfit-Lösung[9] oder in einem Gemisch von Essigsäure, Phosphorsäure und Wasserstoffperoxid[22] erzielt werden.
Anwendungen
Polymere
Die wichtigste Anwendung ist als Monomerbaustein in Polyamiden und Polyester durch Polykondensation mit Diaminen bzw. Diolen. Wichtigstes Polymer ist Polyamid 612 durch Polykondensation mit 1,6-Diaminohexan, das wegen seines hohen Schmelzpunktes (218 °C), der geringen Wasseraufnahme und guten Hydrolyse-, Chemikalien- und Witterungsbeständigkeit für hochbelastete Teile im Fahrzeugbau eingesetzt wird. Hersteller von PA 612 sind Dupont (Zytel®), EMS-Chemie (Grilamid 2d®), Evonik (Vestamid D®)[23] und Ube (Ubesta®).
In den 1970er Jahren wurden von Dupont seidenartige Polyamid-Textilfasern aus DDDA und trans, trans-Bis(4-aminocyclohexyl)methan unter dem Markennamen Qiana® vermarktet, die wegen ihres trilobalen Faserquerschnitts besonders weich und hochglänzend waren, aber im Vergleich zu herkömmlichen Nylonfasern geringe Reißfestigkeiten aufwiesen und sich am Markt nicht durchsetzen konnten.[24]
Im Gegensatz zu Polyamiden aus DDDA haben Polyester relativ niedrige Schmelzpunkte (70 bis 90 °C) und ähneln in ihren Eigenschaften dem Polyolefin Polyethylen.[25]
Ester
Diester von DDDA mit niederen Alkoholen wie Methanol und Isopropanol besitzen wie macrocyclische Ketone oder Lactone ähnlicher Kettenlänge Duftstoffeigenschaften, die im Fall des Dimethylesters als „schön nach Moschus, heiß aldehydig, nach ausgeblasener Kerze, leicht holzig“ und beim Diisopropylester als „nach Moschus, warm, nach ausgeblasener Kerze, schwach holzig“ beschrieben sind.[26]
Diester mit höheren Alkoholen, wie z. B. 2-Ethylhexanol oder Isotridecanol sind geruchlos und können als Lösungsmittel für Parfümkompositionen verwendet werden.[27]
Diester der 1,12-Dodecandisäure werden auch als synthetische Schmiermittel und Weichmacher eingesetzt.[2]
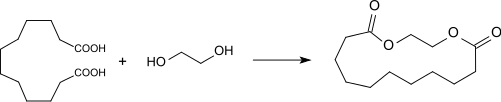
Der cyclische Ester aus DDDA und Ethylenglycol riecht ebenfalls moschusartig und ist ein sehr gutes Fixativ in der Parfümherstellung.[28][29]
O-Derivate
Katalytische Hydrierung von DDDA bzw. seiner Diester führt zu 1,12-Dodecandiol,[30] das sich als langkettiges Diol zur Herstellung von Polyestern, Polyurethanen, Polycarbonaten und Epoxidharzen eignet.
N-Derivate
Aus DDDA ist durch Umsetzung mit Ammoniak und anschließender Abspaltung von Wasser mit Dodecandinitril als Lösungsmittel in Gegenwart von 85%iger Orthophosphorsäure bei Reaktionstemperaturen bis 345 °C in Ausbeuten bis 93 % d.Th. Dodecandinitril[31] erhalten, das durch katalytische Hydrierung in das u. a. als Diamin für Polyamid- oder Polyurethansynthesen interessante 1,12-Dodecandiamin überführt werden kann.[32]
DDDA findet ferner Verwendung in Klebstoffen und Schmelzklebern, Korrosionsinhibitoren, Tensiden, Elektrolyten für Kondensatoren, als Vernetzer in Pulverlacken usw.[2][17]
Einzelnachweise
- Eintrag zu Dodecandisäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. September 2014. (JavaScript erforderlich)
- Invista, Technical Information C12, Dodecanedioic Acid (DDDA) (Memento vom 6. Oktober 2014 im Internet Archive), abgerufen am 1. Oktober 2014.
- Datenblatt Dodecandisäure (PDF) bei Merck, abgerufen am 1. Oktober 2014.
- G. Oenbrink, T. Schiffer: Ullmann’s Encyclopedia of Industrial Chemistry, 6th Edition. Cyclododecanol, Cyclododecanon and Laurolactam. Wiley-VCH, 2000, doi:10.1002/14356007.a08_201.pub2.
- Ullmann’s Fine Chemicals: Dicarboxylic Acids, Aliphatic. Wiley-VCH, 2014, ISBN 978-3-527-33477-3, S. 592.
- Invista, C12 High Performance Intermediates, C12Process (Memento vom 6. Oktober 2014 im Internet Archive)
- H.-J. Arpe: Industrielle Organische Chemie. 6., vollst. überarb. Auflage. Wiley-VCH, 2007, ISBN 978-3-527-31540-6.
- Patent US3087963: Preparation of 1,12-dodecanedioic acid. Veröffentlicht am 30. April 1963, Anmelder: Esso Research and Engineering Co., Erfinder: H. K. Wiese, S. B. Lippincott.
- Patent US3903152: Process for producing highly pure 1,12-dodecanedioic acid. Angemeldet am 29. Juni 1973, veröffentlicht am 2. September 1975, Anmelder: Toagosei Chemical Industry C. Ltd., Erfinder: T. Matsubara, Y. Ishibashi, Y. Okada.
- Patent EP2407444: Process for the preparation of dodecanedioic acid. Angemeldet am 18. März 2009, veröffentlicht am 18. Januar 2012, Anmelder: Invista Technologies S.a.r.l., Erfinder: G. Rajendran.
- T. M. Oshnyakova, N. A. Shchadneva, R. I. Khusnutdinov, U. M. Dzhemilev: Addition of Water and Carbon Tetrachloride to Cyclododecene in the Presence of Chromium Catalysts. In: Russ. J. Org. Chem. Band 44, Nr. 8, 2008, ISSN 1070-4280, S. 1240–1242.
- Patent DE2942279A1: Verfahren zur Umsetzung von Olefinen in carbonsaurem Medium mit Ozon. Angemeldet am 19. Oktober 1979, veröffentlicht am 30. April 1981, Anmelder: Chemische Werke Hüls AG, Erfinder: K. D. Dohm, P. Hofmann.
- Patent WO03022792A1: One step process for producing dicarboxylic acids. Angemeldet am 4. September 2002, veröffentlicht am 20. März 2003, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: C.A. Thayer II.
- Patent US3907883: Process for production of 1,12-dodecanedioic acid. Veröffentlicht am 23. September 1975, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: D.E. Welton.
- Patent EP0258535: Verfahren zur Herstellung von 1,12-Dodecandisäure II.. Angemeldet am 19. Mai 1987, Anmelder: Degussa AG, Erfinder: J. Andrade, K. Köhler, G. Prescher.
- Z.-H. Yi, H.-J. Rehm: Metabolic formation of dodecanedioic acid from n-dodecane by a mutant of Candida tropicalis. In: Europ. J. Appl. Microbiol. Biotechnol. Band 14, Nr. 4, 1982, S. 254–258, doi:10.1007/BF00498473.
- K. Kroha: Industrial biotechnology provides opportunities for commercial production of new long-chain dibasic acids. In: inform. Band 15, Nr. 9, 2004, S. 568–571 (PDF).
- Patent WO2013006730: Biological methods for preparing a fatty dicarboxylic acid. Angemeldet am 5. Juli 2012, veröffentlicht am 10. Januar 2013, Anmelder: Verdezyne, Inc., Erfinder: T. Beardslee, S. Picataggio, E. D. Eirich, J. M. Laplaza.
- N.N.: 6.1.2.1. Oxidation von 1,12-Dodecandiol mit Kaliumpermanganat zu Dodecandisäure (1). 9. März 2007 (ioc-praktikum.de [PDF]).
- Dibasic Acids. In: Cathay Industrial Biotech. Cathay Industrial Biotech, abgerufen am 15. März 2019 (englisch).
- Patent US3714244: Method for purifying 1,12-dodecanedioic acid. Angemeldet am 6. April 1971, veröffentlicht am 30. Januar 1973, Anmelder: Toagosei Chemical Industry Co. Ltd., Erfinder: Y. Okada, T. Matsubara.
- Patent US4149013: Process for purifying 1,12-dodecanedioic acid. Angemeldet am 19. Mai 1978, veröffentlicht am 10. April 1979, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: D.A. Klein.
- Evonik Industries: Vestamid D – Polyamid 612
- H.G. Elias: Makromoleküle: Band 3: Industrielle Polymere und Synthesen, 6. Auflage. Wiley-VCH, 2001, ISBN 3-527-29962-9, S. 185.
- G. Barbiroli, C. Lorenzetti, C. Berti, M. Fiorini, P. Manaresi: Polyethylene like polymers. Aliphatic polyesters of dodecanedioic acid: 1. Synthesis and properties. In: Eur. Polym. J. Band 39, Nr. 4, 2003, S. 655–661, doi:10.1016/S0014-3057(02)00280-X.
- Patent EP0103125: Aliphatische Dicarbonsäureester als Riechstoffe und diese enthaltende Parfümkompositionen und parfümierte Produkte. Angemeldet am 27. Juli 1983, veröffentlicht am 21. Oktober 1987, Anmelder: Haarmann & Reimer GmbH, Erfinder: W. Sturm, G. Mansfeld, H. Reindl.
- Patent EP1707185: Solvent materials and methods for preparing fragrance compositions. Angemeldet am 26. Januar 2006, veröffentlicht am 2. Oktober 2006, Anmelder: International Flavors & Fragrances, Inc., Erfinder: A.P.S. Narula, A.T. Levorse, Jr., J.S. Huang.
- Patent US5717111: Process for the continuous preparation of macrocyclic compounds. Angemeldet am 8. März 1996, veröffentlicht am 10. Februar 1998, Anmelder: Hüls AG, Erfinder: G. Köhler, M. Feld, J. Metz.
- Invista: C12 High Performance Intermediates, Macrocyclics, Cyclic Esters (Memento vom 6. Oktober 2014 im Internet Archive)
- Condea: Dr. Z presents All about fatty alcohols, Saturated Fatty Alcohols (Memento vom 27. September 2007 im Internet Archive), 2000.
- Patent US3707546: Process for preparing dodecanedinitrile. Angemeldet am 2. April 1971, veröffentlicht am 26. Dezember 1972, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: D. A. Klein.
- Patent US3987099: Process for the hydrogenation of dodecanedioic acid dinitrile. Angemeldet am 24. Oktober 1974, veröffentlicht am 19. Oktober 1976, Anmelder: Chemische Werke Hüls AG, Erfinder: G. Hockele, G. Ludwig.
