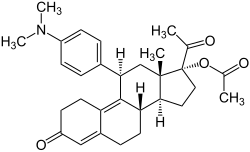
Ulipristalacetat
Ulipristalacetat wird in der Gynäkologie als Pille danach zur Notfallkontrazeption eingesetzt. In niedrigerer Dosisstärke wird es zur Behandlung von gutartigen Tumoren der Gebärmutter verwendet (Handelsname Esmya).[3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ulipristalacetat | |||||||||||||||||||||
| Andere Namen |
(8S,11S,13S,14R,17R)-17-Acetoxy-11-[4-(dimethylamino)phenyl]-19-norpregna-4,9-dien-3,20-dion (IUPAC) | |||||||||||||||||||||
| Summenformel | C30H37NO4 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
| |||||||||||||||||||||
| Wirkmechanismus |
Progesteron-Rezeptormodulator | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 475,62 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
In den Ländern der EU ist Ulipristalacetat zur Notfallverhütung seit 2009 als ellaOne zugelassen.[4] Esmya wurde 2012 zugelassen; wegen des Risikos für schwere Leberschäden darf dieses Arzneimittel nur noch sehr eingeschränkt zur Anwendung kommen.
Wirkprinzip
Die erwünschte Wirkung von Ulipristalacetat beruht auf der Hemmung der Bindung des körpereigenen Gestagens Progesteron an den zugehörigen Rezeptoren. Dadurch kann sowohl der Eisprung bei der Frau verhindert oder verzögert als auch die tumorfördernde Wirkung von Progesteron auf Uterusmyome unterdrückt werden.[1][3]
Der Verdacht auf eine zusätzliche kontrazeptive Wirkung durch Hemmung der Einnistung der befruchteten Eizelle in die Gebärmutterschleimhaut wurde Anfang 2014 diskutiert.[5]
Anwendungsgebiete
Notfallkontrazeption
Ulipristalacetat kann bis zu 120 Stunden nach ungeschütztem Geschlechtsverkehr oder dem Versagen angewandter Verhütungsmittel zur Notfallkontrazeption eingesetzt werden. Zur Vermeidung einer ungewollten Schwangerschaft wird eine Tablette EllaOne bzw. Ella zu 30 mg Ulipristalacetat frühestmöglich als Einmaldosis verabreicht. Die Wirksamkeit des Präparats ist unabhängig von der Einnahme zu oder außerhalb einer Mahlzeit gegeben. Kommt es innerhalb von drei Stunden nach der Einnahme zum Erbrechen, muss das Präparat nochmals eingenommen werden. Ulipristalacetat ist nicht zur routinemäßigen Schwangerschaftsverhütung zu verwenden.[6] Es ist für alle Frauen im gebärfähigen Alter einschließlich Jugendlicher geeignet. Hinsichtlich der Wirksamkeit und Sicherheit gegenüber der Anwendung durch Erwachsene wurden keine Unterschiede festgestellt.[6]
Behandlung gutartiger Gebärmuttertumore
Zur Myombehandlung wird erwachsenen Frauen vor der Menopause während einer Frist bis zu drei Monaten täglich eine Tablette Esmya zu fünf Milligramm Ulipristalacetat verabreicht; die Behandlung beginnt in der ersten Woche des Menstruationszyklus. Bei unzureichender Wirkung kann die Behandlung einmal wiederholt werden. Durch die Abschirmung der Progesteronaktivität werden die Tumorzellen abgetötet, was zur Schrumpfung des Myoms und einem Rückgang seiner Auswirkungen führt.[7] In entsprechenden Studien wurde Ulipristalacetat eine ähnlich hohe Wirksamkeit wie Leuprorelin bescheinigt.[3]
Nebenwirkungen und Anwendungsbeschränkungen
Die am häufigsten berichteten Nebenwirkungen sind Kopfschmerzen, Übelkeit mit und ohne Erbrechen, Unterleibsschmerzen, Muskel- und Rückenschmerzen, Müdigkeit und Menstruationsbeschwerden. Seltener traten unter der Behandlung mit Ulipristalacetat Stimmungsschwankungen, Appetitstörungen, Migräne, Sehstörungen, Akne, Juckreiz, Fieber oder Hitzewallungen auf.[6]
Die bisherigen Erfahrungen mit Überdosen von Ulipristalacetat sind begrenzt. In der Vergangenheit wurden Einzeldosen bis zu 200 mg ohne ernsthafte Folgen überstanden.[6]
Die gleichzeitige Anwendung mit Rifampicin, Phenytoin, Carbamazepin, Phenobarbital, Efavirenz, Phosphenytoin, Nevirapin, Oxcarbazepin, Primidon, Rifabutin, Ritanovir, Johanniskrautpräparaten und dem gleichfalls als Pille danach geeigneten Levonorgestrel wird nicht empfohlen. Ulipristalacetat kann die Wirkung anderer hormoneller Verhütungsmittel auf alleiniger Gestagen- und/oder Gestagen-Estrogen-Basis abschwächen.[6]
Die Substanz darf nicht bei bekannter Allergie gegen Ulipristalacetat angewendet werden. Ein Übertritt in die Muttermilch mit der Gefahr des Auftretens von Wirkungen beim Säugling findet statt, weshalb die Notfallverhütung mit Ulipristalacetat in der Stillzeit nicht empfohlen ist. In der Therapie gutartiger Gebärmuttertumoren ist Ulipristalacetat in der Schwangerschaft und Stillzeit kontraindiziert. Vorsichtshalber sollten während der Behandlung Kraftfahrzeuge nicht geführt und Maschinen nicht bedient werden, auch wenn die Auswirkung auf die Reaktionsfähigkeit als geringfügig bis moderat eingeschätzt wird und nur selten über Sehstörungen berichtet wurde.[6]
Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittel-Agentur (EMA) hatte im Dezember 2017 ein Risikobewertungsverfahren für das Medikament Esmya eingeleitet, um vier Berichte über schwere Leberschäden bei Patientinnen, die mit Ulipristalacetat behandelt wurden, und mögliche Konsequenzen für den Einsatz des Medikaments zu prüfen. Ab Februar 2018 wurde eine regelmäßige engmaschige laborchemische Überwachung der Patientinnen empfohlen. Nachdem trotz Einhaltung dieser eingeführten Maßnahmen zur Risikominimierung im Dezember 2019 ein neuer Fall einer schweren Leberschädigung nach Behandlung mit Esmya berichtet wurde, ordnete das BfArM übergangsweise ein Ruhen der Zulassung an.[8] Nach einem weiteren Bewertungsverfahren darf das Medikament seit Januar 2021 nur noch äußerst eingeschränkt angewendet werden. Zulässig ist es nur noch, um Gebärmuttermyome bei prämenopausalen Frauen zu behandeln, bei denen chirurgische Eingriffe nicht geeignet sind oder nicht erfolgreich waren. Die Patientinnen sind umfassend über die Risiken zu informieren, um ihnen eine informierte Entscheidung zu ermöglichen.[9]
Hingegen gab es keine Berichte über Leberschäden durch die Einnahme von Ulipristalacetat als Notfall-Empfängnisverhütungsmittels, weshalb dieses Medikament auch nicht auf dem Prüfstand stand.[10][11] Es bestehen keine Bedenken bezüglich des Auftretens von Leberschäden bei der Verwendung von Ulipristal als Pille danach.[9]
Fertigarzneimittel
- Ulipristalacetat zur Notfallverhütung (30 mg): Ella (USA, CND), EllaOne (EU) und Generika (Lencya, Femke und andere)
- Ulipristalacetat zur Behandlung von Gebärmuttermyomen (5 mg): Esmya (EU), Fibristal (CND)
Seit Ende Mai 2020 ist der Patentschutz für EllaOne abgelaufen.[12]
Verkaufsabgrenzung
Wegfall der Rezeptpflicht 2015
In den Ländern der Europäischen Union unterlag Ulipristalacetat seit seiner Einführung der Verschreibungspflicht. Der Europäischen Arzneimittelbehörde lag im Februar 2014 ein Antrag auf die EU-weite Entlassung des Ulipristalacetat-haltigen Medikamentes EllaOne aus der Rezeptpflicht vor.[13] Eine Rezeptfreistellung von neueren Präparaten durch die EU ist auch gegen den Willen der einzelnen Mitgliedsstaaten möglich, da die Zulassung (anders als im Fall Levonorgestrel) auf gesamteuropäischer Ebene erfolgt ist.[14] In Großbritannien und Nordirland war Ulipristalacetat im Rahmen eines Versuchs als apothekenpflichtiges Arzneimittel rezeptfrei abgegeben worden (Stand vom 25. Juli 2014).[15]
Am 8. Januar 2015 beschloss die EU-Kommission die EU-weite Aufhebung der Rezeptpflicht für die Pille danach.
Mit Entlassung aus der Rezeptpflicht[16] zum 14. März 2015 wurde auch die Kostenübernahme durch die Krankenkasse für Patientinnen unter 20 Jahren verordnet.[17] Die Abgabe im Versandhandel ist nicht erlaubt. Die direkte Bewerbung des Präparats ist verboten.[18] Die Abgabe an Jugendliche ab 14 Jahren ist auch ohne Einwilligung der Erziehungsberechtigten zugelassen.[19]
In Form des Präparats Esmya bleibt Ulipristalacetat weiterhin verschreibungspflichtig.
Rechtslage in Polen
Nachdem die Rezeptpflicht 2015 EU-weit weggefallen war, war ellaOne in Polen nach kurzer Zeit ausverkauft.[20] 2017 wurde es auf Bestreben der rechtsgerichteten Regierungspartei Recht und Gerechtigkeit im Juni 2017 nach einer entsprechenden Gesetzesänderung wieder der Rezeptpflicht unterstellt.[21]
Rechtslage in den USA
In den Vereinigten Staaten sind Apotheken rechtlich zur Abgabe ärztlich verordneten Ulipristalacetats als Notfallkontrazeptivum verpflichtet. Einzelne Apotheker, deren religiöse Überzeugungen der Abgabe widersprechen, dürfen letztere nur dann verweigern, wenn ein anderer Mitarbeiter derselben Apotheke das Präparat zeitnah an die Patientin aushändigt. Dies entschied der Oberste Gerichtshof verbindlich im Juli 2016. In den meisten anderen Fällen können Apotheker in den USA selbst entscheiden, welche Produkte sie führen.[22]
Vertriebsweg
Die Anwendung von Ulipristalacetat gilt nach deutschem Recht nicht als Schwangerschaftsabbruch (§ 218 Abs. 1 Satz 2 StGB), da kein nachweislicher Ausstoß der befruchteten Eizelle aus der Gebärmutterschleimhaut stattfindet und die Schwangerschaft rechtlich erst mit der Einnistung der Eizelle in der Gebärmutter beginnt. Dementsprechend ist ein Sondervertriebsweg nach § 47a AMG nicht vorgesehen und das Präparat wird in der Apotheke direkt an die Patientin abgegeben.
Kontroverse
Zum Zeitpunkt der Zulassung waren normale Lebendgeburten nach Gabe unterschiedlicher Dosen Ulipristalacetat bekannt, insgesamt war die Datenlage zur Auswirkung einer Exposition auf die Schwangerschaft aber sehr begrenzt.[1] Unter Berufung auf die Behauptung, dass „aktuellen Forschungen zufolge“ Ulipristalacetat die Einnistung befruchteter Eizellen in der Gebärmutter verhindere oder zur Abstoßung bereits eingenisteter Eizellen führe, schrieben im Jahr 2014 Teile der Lebensrechtsbewegung und der römisch-katholischen Kirche dem Mittel eine „frühabtreibende Wirkung“ und ein der „Abtreibungspille“ Mifepriston ähnliches Wirkprinzip zu (siehe hierzu auch behauptete Wirkung) und warnten vor der Freigabe.[23] Den Angaben in den Zulassungsunterlagen zufolge führt Ulipristalacetat nicht zum Abbruch einer bestehenden Schwangerschaft.[6]
Einzelnachweise
- CHMP Assessment Report for EllaOne (PDF; 776 kB) Juni 2009.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (1R,3aS,3bS,10R,11aS)-1-acetyl-10-[4-(dimethylamino)phenyl]-11a-methyl-7-oxo-1H,2H,3H,3aH,3bH,4H,5H,7H,8H,9H,10H,11H,11aH-cyclopenta[a]phenanthren-1-yl acetate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. März 2019.
- European Medicines Agency: Esmya, INN-Ulipristal. (PDF; 117 kB) Abgerufen am 23. Juni 2014.
- Wirkmechanismus der Pille danach. (PDF; 364 kB) Pro Familia.
- B. Mozzanega, S. Gizzo, S. Di Gangi, E. Cosmi, G. B. Nardelli: Ulipristal acetate: critical review about endometrial and ovulatory effects in emergency contraception. Department of Woman and Child Health, University of Padua, Padova, Italy In: Reproductive sciences (Thousand Oaks, Calif.). Band 21, Nummer 6, Juni 2014, S. 678–685, doi:10.1177/1933719113519178, PMID 24440997 (abstract).
- Zusammenfassung der Merkmale des Arzneimittels, EllaOne 30 mg. Europäische Arzneimittelagentur, Stand Mai 2020; ema.europa.eu (PDF; 537 kB).
- Guillaume E. Courtoy, Jacques Donnez, Etienne Marbaix, Marie-Madeleine Dolmans: In vivo mechanisms of uterine myoma volume reduction with ulipristal acetate treatment. In: Fertility and Sterility. Band 104, Nr. 2, August 2015, S. 426–434.e1, doi:10.1016/j.fertnstert.2015.04.025, PMID 26003270.
- Rote-Hand-Brief zu Ulipristalacetat 5 mg: Keine Anwendung zur Behandlung von Gebärmuttermyomen während des laufenden Bewertungsverfahrens zum Risiko für Leberschädigungen. Bundesinstitut für Arzneimittel und Medizinprodukte, 23. März 2020.
- Ulipristalacetat 5 mg (Arzneimittel zur Behandlung von Gebärmuttermyomen): Risiko für Leberschädigungen. In: www.bfarm.de. 2. Februar 2021, abgerufen am 18. März 2021.
- EMA starts review of Esmya for uterine fibroids.
- Esmya® (Ulipristalacetat) zur Behandlung von Uterusmyomen: PRAC verabschiedet vorläufige Maßnahmen zum Schutz der Patientinnen. (Memento vom 12. Februar 2018 im Internet Archive) vom 9. Februar 2018.
- N. Tröbitscher: EllaOne: Generika von Hexal, Mylan und Aliud. In: apotheke-adhoc.de. Abgerufen am 30. Juni 2020.
- EU erwägt Aufhebung der Rezeptpflicht für „Pille danach“. In: Ärzteblatt, 24. Februar 2014.
- Pille danach: Europäische Arzneimittelbehörde prüft Freigabe von „Ellaone“. In: Spiegel online, 24. Februar 2014.
- Emergency Contraception Availability in Europe. European Consortium for Emergency Contraception; abgerufen am 25. Juli 2014.
- BGBl. I S. 278
- Bundesrat stimmt rezeptfreier „Pille danach“ zu. In: Süddeutsche Zeitung, 6. März 2015.
- § 10 Heilmittelwerbegesetz.
- Rezeptfreie Abgabe von Notfallkontrazeptiva („Pille danach“). (Memento vom 2. April 2015 im Internet Archive; PDF) Bundesapothekerkammer, Stand 28. Januar 2015, S. 10; abgerufen am 27. Februar 2015.
- Julia Szyndzielorz: Polen streitet über die Pille danach. In: Welt online, 2. Februar 2015.
- Julia Borsch: Polens Alleingang bei der „Pille danach“. In: Deutsche Apotheker-Zeitung, 28. Juni 2017.
- Gläubige Apotheker müssen „Pille danach“ abgeben. In: Apotheke Adhoc, 3. Juli 2016.
- Neue ‚Pille danach‘: IMABE-Institut warnt vor Freigabe. In: kath.net, 12. April 2014.