Mifepriston
Mifepriston ist ein Progesteron- und Glukokortikoid-Rezeptorantagonist.[3] Es hemmt die Wirkung des Gestagens Progesteron dadurch, dass es eine fünfmal höhere Affinität für die Rezeptoren dieses Hormons hat, aber keine Wirkung am Rezeptor auslöst. Außerdem blockiert es die Rezeptoren für Glukokortikoide durch eine dreifach höhere Affinität gegenüber Dexamethason.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
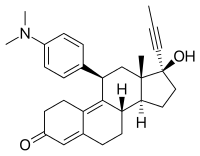 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Mifepriston | |||||||||||||||||||||
| Andere Namen |
17β-Hydroxy-11β-(4-dimethylamino-phenyl)-17α-(1-propinyl)estra-4,9-dien-3-on | |||||||||||||||||||||
| Summenformel | C29H35NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G03XB01 | |||||||||||||||||||||
| Wirkstoffklasse |
| |||||||||||||||||||||
| Wirkmechanismus |
Antagonist am Progesteron-Rezeptor, wodurch es zur Degeneration der Uterusschleimhaut und zur Störung der Plazentafunktion kommt[2] | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 429,60 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
In der Gynäkologie findet Mifepriston in Kombination mit den Prostaglandinen Gemeprost oder Misoprostol Verwendung bei der Herbeiführung eines Schwangerschaftsabbruchs. Es ist der Wirkstoff der ersten sogenannten Abtreibungspille RU-486, die inzwischen unter dem Namen Mifegyne vertrieben wird. Mifepriston wird auch als Langzeittherapeutikum des Hyperkortisolismus im Rahmen eines Cushing-Syndrom verwendet.
Anwendungsgebiete
Schwangerschaftsabbruch
Mifepriston ist der Wirkstoff in der „Abtreibungspille“ (Handelsname: Mifegyne). Mifepriston ist eine kostengünstige Alternative zum gynäkologischen Eingriff und für die betroffenen Frauen mit weniger gesundheitlichen Risiken verbunden, besonders in ärmeren Ländern (z. B. Infektion). Die Abtreibungspille darf nicht mit der Pille danach verwechselt werden.
Die Einnahme von Mifepriston in der Schwangerschaft führt innerhalb von 48 Stunden zum Öffnen des Muttermundes und zur Ablösung der Gebärmutterschleimhaut. Nach 36 bis 48 Stunden wendet die Schwangere ein Prostaglandin an, beispielsweise Gemeprost oder Misoprostol. Die Prostaglandintabletten werden entweder eingenommen oder in die Scheide eingeführt. Dies bewirkt, dass sich die Gebärmutter zusammenzieht, es wird ein künstlicher Abort ausgelöst und die Frucht wird ausgestoßen. Mifepriston ist während der ganzen Schwangerschaft wirksam, hat laut Studien jedoch die höchste Erfolgsrate bei der Einnahme vor dem 49. Tag. Die Wirkung auf den Muttermund ist auch bei nicht schwangeren Frauen gegeben und wird vor bestimmten gynäkologischen Eingriffen genutzt.
Cushing-Syndrom
In der Behandlung des Cushing-Syndroms soll Mifepriston als Glucocorticoid-Rezeptorantagonist wirken. Die Blockade des Rezeptors unterdrückt die Anbindung des natürlichen Liganden Cortisol und infolgedessen auch seine Wirkung.
Außerdem wird es zur Behandlung einer (sekundären) Hyperglykämie verwendet, wenn der erhöhte Blutzuckerspiegel durch hohe Cortisolspiegel im Blut (Hyperkortisolismus) verursacht wird. Dies tritt im Rahmen eines endogenen Cushing-Syndrom auf.[4][5]
Entwicklung und späte Zulassung
Ab 1980 wurde RU-486 vom Pharmalabor Roussel Uclaf (RU; heute Teil von Sanofi-Aventis) gegen erhebliche Widerstände der Hoechst AG, die 1974 56 % des zweitgrößten französischen Pharmakonzerns erworben hatte, entwickelt. Bereits vor der Zulassung erregte es Aufsehen – Teile der Frauenbewegung begrüßten die Entwicklung des Wirkstoffes, Abtreibungsgegner liefen Sturm dagegen. Zunächst bewilligte Frankreichs Minister für Solidarität, Gesundheit und sozialen Schutz Evin am 23. September 1988 den Einsatz von Mifepriston in den rund 800 Abtreibungskliniken des Landes. Einen Monat nach Markteinführung zog es der Vorstand aus politischen Gründen (Reaktionen aus religiösen Kreisen) zurück und erst auf Anordnung des Gesundheitsministers (36,25 % gehörten dem Staat) wurde es wieder begrenzt erhältlich. Selbst zur Forschung nach weiteren Indikationen wurde Mifepriston weltweit fast nicht abgegeben. In Deutschland weigerte sich die Hoechst AG beharrlich, eine Zulassung ihres Wirkstoffes zu beantragen, und trug u. a. vor, dass sie einen Boykott ihrer Produkte befürchte.
Siehe Anfang der 1990er Jahre: Schlechterstellung der Frauen der ehemaligen DDR unter der Wiedervereinigung durch § 218
1997 übertrug Hoechst die Rechte an dem Wirkstoff unentgeltlich an den ehemaligen RU-Vorstand und Erfinder Edouard Sakiz. 1998 erfolgte die Zulassung in Großbritannien und Schweden.[6] In Deutschland wurde Mifepriston am 22. November 1999 zugelassen[7]. Die Schweiz und andere europäische Länder folgten, sowie die USA im September 2000.
Die Einnahme für den Schwangerschaftsabbruch wurde ursprünglich bis zur 7. Schwangerschaftswoche (49. Tag) nach Beginn der letzten Menstruation zugelassen, in Großbritannien und Schweden bis zum 63. Tag. 2007 ordnete die EU-Kommission den Mitgliedsstaaten eine Zulassungsänderung an, mit der das Anwendungsgebiet auf den Schwangerschaftsabbruch bis zur 9. Woche (63. Tag) – bei anschließender Verwendung eines Prostaglandinanalogs – EU-weit vereinheitlicht wurde.[8] In der Schweiz gilt die Zulassung immer noch bis zum 49. Tag. Für medizinisch notwendige Abbrüche ist Mifepriston auch später in der Schwangerschaft zugelassen und derzeit (in Kombination mit Misoprostol) die effizienteste Methode. Es gibt jedoch viele sogenannte Off-Label-Anwendungen: Bis zur 12. Woche, andere Dosierung, andere Indikationen wie Endometriose (Wucherung der Gebärmutterschleimhaut) oder als Pille danach.
Nach § 47a des deutschen Arzneimittelgesetzes darf dieses Arzneimittel nur direkt an bestimmte Einrichtungen, in denen Schwangerschaftsabbrüche vorgenommen werden, und nur auf Verschreibung eines dort behandelnden Arztes abgegeben werden. Es darf nicht über die Apotheke in Verkehr gebracht werden. In Österreich darf Mifepriston seit Juli 2020 auch von niedergelassenen Frauenärzten zum Zweck des Schwangerschaftsabbruchs abgegeben werden.[9]
Gegenanzeigen
Bei Patienten mit Nierenversagen oder Leberversagen, chronischer Nierenschwäche, schwerem oder unzureichend behandeltem Asthma bronchiale sowie starkem Untergewicht ist die Behandlung mit dem Wirkstoff nicht erlaubt. Ab dem 64. Tag einer Schwangerschaft nach Ausbleiben der Regelblutung darf Mifepriston nicht mehr eingesetzt werden.
Nebenwirkungen
Die meisten Nebenwirkungen sind nicht Mifepriston, sondern dem im Rahmen eines Schwangerschaftsabbruchs ebenso verabreichten Prostaglandin (z. B. Misoprostol) zuzuschreiben.
Als leichte Nebenwirkungen können Übelkeit, Erbrechen, Durchfall, Kopfschmerzen, Hitzewallungen auftreten. Häufig bewirken die Gebärmutter-Kontraktionen mehr oder weniger starke Schmerzen. Starke Blutungen treten in etwa 5 % der Fälle auf und können in bis zu 1,4 % der Fälle eine Kürettage erforderlich machen. Über Infektionen wurde bei weniger als 5 % der Frauen berichtet. Während der Einleitung eines Schwangerschaftsabbruchs im zweiten Trimester oder der Einleitung von Wehen wegen Tod des Fetus in utero während des dritten Trimesters wurde in seltenen Fällen eine Uterusruptur nach der Prostaglandin-Aufnahme berichtet. Das betraf insbesondere Mehrfachgebärende oder Patientinnen mit Kaiserschnitt-Narbe. Misserfolgsrate: 1,3 % bis 7,5 %. Eine teratogene Wirkung (Schädigung des Embryos) durch Mifepriston kann nicht völlig ausgeschlossen werden. Bei Misoprostol (Cytotec) wird sie angenommen. Deshalb wird Frauen in den ca. 1 % der Fälle, in welchen die Schwangerschaft sich weiter entwickelt, dringend ein chirurgischer Abbruch empfohlen.
Siehe auch
Einzelnachweise
- Datenblatt Mifepristone bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
- Mutschler, Geisslinger, Kroemer, Schäfer-Korting, Mutschler Arzneimittelwirkungen, 8. Auflage, 2001, ISBN 3-8047-1763-2.
- Mifepristone (RU486) von der FDA bei besonderen Fällen von Cushing-Syndrom zugelassen - Deutsche Gesellschaft für Endokrinologie
- Wannachalee, T., Turcu, A. F., & Auchus, R. J. (2018). Mifepristone in the treatment of the ectopic adrenocorticotropic hormone syndrome. Clinical endocrinology, 89(5), 570-576. doi:10.1111/cen.13818 PMID 30019523
- Pivonello, R., De Martino, M. C., De Leo, M., Simeoli, C., & Colao, A. (2017). Cushing’s disease: the burden of illness. Endocrine, 56(1), 10-18 doi:10.1007/s12020-016-0984-8 PMID 27189147
- Hexal-Tochter vertreibt Mifegyne pharmazeutische-zeitung.de, abgerufen am 24. November 2018
- JETZT AUCH IN DEUTSCHLAND: MIFEPRISTON arznei-telegramm.de, am 19. November 1999, abgerufen am 24. November 2018
- Mifegyne (Wirkstoff Mifeproston): Die EU-Kommission beschließt Änderungen der Produktinformationen des Arzneimittels, BfArM 10. März 2008.
- "Abtreibungspille" Mifegyne wird in Österreich leichter zugänglich. Der Standard, 2. Juli 2020
Weblinks
- Die Abtreibungspille – Vergleich chirurgische Abtreibung und Abtreibungspille auf der Seite der Schweizerischen Vereinigung für Straflosigkeit des Schwangerschaftsabbruchs
- profamilia.de – Informationen bei pro familia