Q-Zyklus
Der Q-Zyklus (von engl. Quinone) bezeichnet in der Biochemie meist eine Folge von Redoxreaktionen unter der Beteiligung von Ubichinon (Q) bzw. Ubihydrochinon (QH2) und Cytochrom c am Komplex III der Atmungskette. Ein ähnlicher Zyklus findet mit Plastochinon (PQ) am Cytochrom-b6f-Komplex in Pflanzen, Algen und Cyanobakterien statt.[1] Dieser erfüllt für das Pendant der Atmungskette, die Photosynthese, dieselbe Funktion wie Komplex III.
Funktion
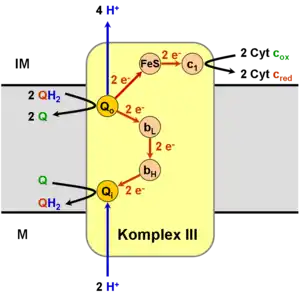
Ubichinon dient in der Atmungskette als beweglicher Elektronenüberträger zwischen Komplex I bzw. Komplex II und Komplex III in der inneren Membran von Mitochondrien. Das Ubichinon wird vom Komplex I/II unter Aufnahme von zwei Elektronen und zwei Protonen zu Ubihydrochinon reduziert. Das Ubihydrochinon kann nun in der Membran zu Komplex III diffundieren um seine beiden aufgenommenen Elektronen weiterzugeben. Ubihydrochinon bindet hierzu an die als Qo bezeichnete Bindestelle im Komplex III, die dem Zwischenraum zwischen innerer und äußerer Membran zugewandt ist (IM). Als Elektronenakzeptor in der Membran dient Cytochrom c, vermittelt durch das ein Eisen-Schwefel-Zentrum enthaltende Rieske-Protein und Cytochrom c1, die Bestandteile von Komplex III sind.
Cytochrom c kann allerdings nur ein Elektron aufnehmen, daher wird zunächst QH2 nur zum freien Radikal Ubisemichinon (QH•) oxidiert. Dieses ist aber instabil und gibt das zweite Elektron sofort über die Proteine Cytochrom bL und Cytochrom bH des Komplexes an ein weiteres Ubichinon ab, das an der inneren, matrixseitigen (M) Bindestelle Qi gebunden ist. Dieses wird zum Radikal Ubisemichinon (QH•) reduziert. Ein an der Qo-Stelle neu hinzukommendes Ubihydrochinon gibt nun seine Protonen an den Intermembranraum ab und liegt wieder in seiner oxidierten Form vor. Es diffundiert von der Qo-Stelle ab und geht in den Ubichinonpool ein.[2]
In einem zweiten Schritt bindet nun ein weiteres Ubihydrochinon an die Qo-Stelle und wird analog zu Ubichinon oxidiert, wobei wieder ein Elektron an Cytochrom c weitergegeben wird und zwei Protonen in den Intermembranraum transferiert werden. Das Ubisemichinon an der Qi-Stelle wird hierbei unter Bindung zweier Protonen aus der Matrix zu Hydrochinon reduziert, wird durch oxidiertes Chinon ersetzt und kann nun selbst an die Qo-Stelle binden.[2]
Bei diesem zyklischen Prozess werden also in der Summe zwei Elektronen zwischen Ubihydrochinon und Cytochrom c weitergegeben und dabei zwei Protonen aus der Matrix entnommen und vier Protonen in den Intermembranraum abgegeben. Dadurch wird ein chemiosmotisches Membranpotenzial zwischen der Matrix und dem Intermembranraum im Mitochondrium aufgebaut.[2]
Entstehen des Radikals Superoxid
Wird der Fluss des zweiten Elektrons zur Qi-Stelle blockiert, experimentell etwa durch Antimycin A, so bleibt QH• länger an der Qo-Stelle. Es findet Autooxidation statt, das freigesetzte Elektron wird durch ein Sauerstoffmolekül aufgenommen und so das freie Radikal Superoxid (O2•−) gebildet. Dies legt nahe, dass an Komplex III mehr Superoxid in den Membranzwischenraum abgegeben wird, was für Mitoplasten ohne äußere Membran bestätigt wurde. Jedoch können auch matrixseitig reaktive Sauerstoffspezies gebildet werden, besonders bei geringem Elektronentransfer in das Qo-Zentrum. Die relativen Produktionsraten und Bedingungen unter physiologischen Verhältnissen sind ungeklärt.[2]
Geschichte
Früher nahm man an, dass die Elektronen von den membrangebundenen Enzymkomplexen der Atmungskette und den zwischengeschalteten beweglichen Elektronenüberträgern (Ubichinon und Cytochrom c) kaskadenartig an den Sauerstoff weitergeleitet würden. Dieses Bild eines geradlinigen Elektronenflusses begann sich Mitte der sechziger Jahre zu wandeln, als der spätere Nobelpreisträger Peter D. Mitchell, zunächst aufgrund rechnerischer Überlegungen, zur Überzeugung gelangte, dass vom Ubichinon nur eines statt der ursprünglich angenommenen zwei gebundenen Elektronen weitergegeben wird.
Diese Theorie wurde untermauert, als die Gruppe um Hans Reichenbach (GBF Braunschweig) in den siebziger Jahren den Hemmstoff Myxothiazol aus dem Myxobakterium Myxococcus fulvus isolierten. Damit gelang es Gebhard von Jagow (Universität München), die Atmungskette exakt dort zu blockieren, wo die Elektronen vom Ubichinon weiter in Richtung Sauerstoff fließen; der zweite Weg konnte mit dem Antibiotikum Antimycin A abgeriegelt werden.
Die Atmungskette verzweigt sich also am Ubichinon, wobei ein Teil der Energie des linear weitergereichten Elektrons ausreicht, um das zweite Elektron in das Ubichinon-Reservoir "zurückzustrudeln". Der Energiefluss entspricht also nicht einem "Wasserfall", sondern es sind "Staustufen" eingeschaltet, die eine höhere Energieausbeute ermöglichen.
Dieser "Elektronenwirbel" am Ubichinon ist keine Spezialität der Säugermitochondrien: auch in den Chloroplasten der grünen Pflanzen und der Atmungskette der Bakterien teilt sich der Elektronenfluss. Dieser ökonomische Umgang mit Energie hat sich also schon früh in der Evolution durchgesetzt.
Literatur
- Osyczka, A. et al. (2005): Fixing the Q cycle. In: Trends Biochem Sci. Bd. 30, S. 176–182. PMID 15817393 doi:10.1016/0022-5193(76)90124-7
Siehe auch
Belege
- Baniulis et al (2008): Structure-function of the cytochrome b6f complex. In: Photochem Photobiol 84 (6) S. 1349–1358, PMID 19067956
- David F. Stowe und Amadou K. S. Camara: Mitochondrial Reactive Oxygen Species Production in Excitable Cells: Modulators of Mitochondrial and Cell Function (Review). Antioxidants & Redox Signaling, Volume 11, Number 6, 2009, S. 1381–84. PMID 19187004