Abirateron
Abirateron ist eine chemische Verbindung aus der Gruppe der Steroide, die als Arzneistoff zur Hormontherapie und zur Behandlung des kastrationsresistenten Prostatakrebses in der EU zugelassen ist.[2][3]
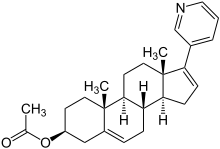
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
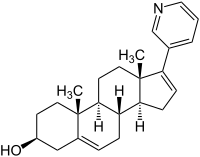 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Abirateron | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H31NO | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L02BX03 | |||||||||||||||||||||
| Wirkmechanismus |
Cyp17A1-Inhibitor | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 349,51 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Abirateron ist die wirksame Form des Prodrugs Abirateronacetat[4] und ist gut oral bioverfügbar. Abirateronacetat ist in Deutschland seit Oktober 2011 im Handel unter dem Handelsnamen Zytiga[5] verfügbar. Abirateron wurde von Cougar Biotechnology Inc. entwickelt. Das Unternehmen wurde 2009 von Johnson & Johnson (J&J) gekauft.[6] In Deutschland wird das Medikament von der J&J-Tochter Janssen-Cilag vermarktet.[7]
Wirkmechanismus
Abirateron ist ein selektiver Inhibitor des Enzyms Steroid-17α-Hydroxylase (CYP17A1), welches Schritte in der Androgen (Testosteron)- und Estrogen-Biosynthese katalysiert. Dadurch senkt es die Hormonproduktion in den Hoden, der Nebenniere und der Prostata.
Frühe Nutzenbewertung
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seinen Beschluss fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Aufgrund von Indikationserweiterungen hat der Wirkstoff mehrere frühe Nutzenbewertungen mit unterschiedlichen zweckmäßigen Vergleichstherapien durchlaufen: Für Patienten mit Prostatakarzinom und Progredienz während oder nach Docetaxel-haltiger Chemotherapie wurde Abirateron in Kombination mit Prednison oder Prednisolon verglichen mit Best Supportive Care.[8] Gemäß G-BA gab es einen Hinweis auf einen beträchtlichen Zusatznutzen.[9] Für Patienten mit Prostatakarzinom, bei denen nach einer Androgenentzugstherapie keine Indikation für eine Chemotherapie besteht, wurde Abirateron verglichen mit einem abwartenden Vorgehen unter Beibehaltung des bestehenden konventionellen Androgenentzugs.[10] Gemäß G-BA gab es erneut einen Hinweis auf einen beträchtlichen Zusatznutzen.[11] Für Hochrisiko-Patienten wurde eine Kombination von Abirateron mit einer Androgenentzugstherapie verglichen mit einem konventionellen Androgenentzug.[12] Gemäß G-BA gab es auch hier einen Hinweis auf einen beträchtlichen Zusatznutzen.[13]
Fertigarzneimittel
Zytiga (D, A, CH, I, USA, CND)
Literatur
- J. E. Ang, D. Olmos, J. S. de Bono: CYP17 blockade by abiraterone: further evidence for frequent continued hormone-dependence in castration-resistant prostate cancer. In: British Journal of Cancer, Band 100, Nr. 5, März 2009, S. 671–675, doi:10.1038/sj.bjc.6604904.
- Neeraj Agarwal, Thomas E. Hutson, Nicholas J. Vogelzang, Guru Sonpavde: Abiraterone acetate: a promising drug for the treatment of castration-resistant prostate cancer. In: Future Oncology, Band 6, Nr. 5, Mai 2010, S. 665–679, doi:10.2217/fon.10.48.
- Charles J. Ryan, Matthew R. Smith, Lawrence Fong, Jonathan E. Rosenberg, Philip Kantoff, Florence Raynaud, Vanessa Martins, Gloria Lee, Thian Kheoh, Jennifer Kim, Arturo Molina, Eric J. Small: Phase I Clinical Trial of the CYP17 Inhibitor Abiraterone Acetate Demonstrating Clinical Activity in Patients With Castration-Resistant Prostate Cancer Who Received Prior Ketoconazole Therapy. In: Journal of Clinical Oncology, Band 28, Nr. 9, 2010, S. 1481–1488, doi:10.1200/JCO.2009.24.1281.
- Daniel C. Danila, Michael J. Morris, Johann S. de Bono, Charles J. Ryan, Samuel R. Denmeade, Matthew R. Smith, Mary-Ellen Taplin, Glenn J. Bubley, Thian Kheoh, Christopher Haqq, Arturo Molina, Aseem Anand, Michael Koscuiszka, Steve M. Larson, Lawrence H. Schwartz, Martin Fleisher Howard I. Scher: Phase II Multicenter Study of Abiraterone Acetate Plus Prednisone Therapy in Patients With Docetaxel-Treated Castration-Resistant Prostate Cancer. In: Journal of Clinical Oncology, Band 28, Nr. 9, 2010, S. 1496–1501, doi:10.1200/JCO.2009.25.9259.
Weblinks
- Zytiga® (Abirateron) – neu zugelassene Indikation (PDF; 127 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), Stand: 15. April 2013
Einzelnachweise
- Eintrag zu Abiraterone bei TCI Europe, abgerufen am 5. November 2019.
- Zytiga: EPAR - Summary for the public. Europäische Arzneimittelagentur (EMA); abgerufen am 1. Dezember 2011.
- „Neue Arzneimittel“ Zytiga (Abirateron) Zur Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms (CRPC) bei erwachsenen Männern. (PDF; 296 kB) Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); abgerufen am 1. Dezember 2011.
- Externe Identifikatoren von bzw. Datenbank-Links zu Abirateronacetat: CAS-Nummer: 154229-18-2, EG-Nummer: 620-314-7, ECHA-InfoCard: 100.149.063, PubChem: 9821849, ChemSpider: 7997598, Wikidata: Q27888393.
- Rote Liste 2017. Verlag Rote Liste Service, Frankfurt am Main, ISBN 978-3-946057-10-9, S. 157.
- Johnson & Johnson (JNJ) Completes Acquisition of Cougar Biotechnology. In: streetinsider.com. Abgerufen am 28. Juli 2016 (englisch).
- WebSite für die Fachkreise: Janssen-Cilag.de abgerufen am 1. Dezember 2011.
- A11-20 Abirateronacetat - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). abgerufen am 23. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Abirateronacetat (Prostatakarzinom, Progredienz während oder nach Docetaxel-haltiger Chemotherapie, Kombination mit Prednison oder Prednisolon). abgerufen am 23. März 2020.
- A13-06 Abirateronacetat (neues Anwendungsgebiet) - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). abgerufen am 23. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Abirateronacetat (neues Anwendungsgebiet: Prostatakarzinom, nach Androgenentzugstherapie, keine Indikation für Chemotherapie). abgerufen am 23. März 2020.
- A18-26 Abirateronacetat (Prostatakarzinom) - Addendum zum Auftrag A17-64. abgerufen am 23. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Abirateronacetat (neues Anwendungsgebiet: Prostatakarzinom, Hochrisiko, Kombination mit Androgenentzugstherapie). abgerufen am 23. März 2020.